Tabela de conteúdos
Ensaios 2023
Um olhar sobre ecologia de comunidades na cidade
Amanda Fernandes Pereira Machado
“Só a Natureza é divina, e ela não é divina…
Se às vezes falo dela como de um ente
É que para falar dela preciso usar da linguagem dos homens
Que dá personalidade às coisas,
E impõe nome às coisas.”
Fernando Pessoa, em seu heterônimo Alberto Caeiro, traz reflexões sobre a busca do ser humano por significados nos fenômenos da natureza. Os fenômenos existem por existir, mas aquele que o observa, o ser humano, atribui um significado que é reflexo de contextos históricos, sociais e culturais. A ciência é feita por pessoas e mesmo com a aplicação de métodos e busca por impessoalidade nas etapas de pesquisa, não pode se negar que toda prática científica será permeada pelas subjetividades. Na Ecologia não é diferente. O objetivo fundamental dessa ciência é compreender como os organismos interagem com o ambiente biótico e abiótico, entretanto, o sistema de estudo da Ecologia (natureza) se caracteriza por alta complexidade e dinamicidade dos processos que levam a um mosaico de teorias propostas para explicações de fenômenos. Como tentativa de organizar os conhecimentos levantados durante toda a história da Ecologia e compreender que há uma relação fundamental entre processos multiescalas, Roughgarden (2009) traz que todas as comunidades ecológicas compartilham alguma versão narrativa comum, permitindo que teoremas gerais sejam desenvolvidos a todas elas. De forma mais concreta, Vellend, (2010) propôs uma forma de olhar para a ecologia de comunidades a partir da compreensão ampla de quatro processos comuns advindos da genética de populações: seleção, especiação, deriva e dispersão e assim, propor uma teoria geral para ecologia de comunidades.
A proposta de Vellend aborda que esses processos influenciam padrões de composição e diversidade das espécies em comunidades ecológicas. As definições desses processos incluem: a seleção, definida como diferenças de aptidão determinística entre espécies; o processo de deriva como mudanças estocásticas na abundância de espécies; a especiação como criação de novas espécies e a dispersão como o movimento de organismos através do espaço. Exemplificando como ocorre esses processos, a seleção pode ser observada, por exemplo, via competição. Levine et al., (2010) levantam a hipótese de que as diferenças de nicho podem estabilizar fortemente a coexistência de plantas anuais. Entendendo a seleção como diferenças de aptidão determinísticas, faz sentido imaginar que a coexistência de espécies depende de trade-offs. Há um balanço entre densidades das espécies às custas das respostas delas sob diferentes condições bióticas ou abióticas e isso, por exemplo, sendo reforçado pela competição (Chesson, 2000). O processo de deriva pode ser entendido como complementar aos outros processos. Por exemplo, pode ser que se a seleção for relativamente forte em uma comunidade grande, a seleção será mais proeminente naquela comunidade em relação à deriva (Vellend, 2010). Entretanto, em uma comunidade com baixa influência de seleção e pequena em tamanho, a deriva será o processo destaque da comunidade em comparação a seleção (Vellend, 2010). A especiação incorpora os processos biogeográficos e macroevolutivos de determinada espécie. Em um modelo em que novas espécies são introduzidas em uma metacomunidade por meio da especiação de espécies existentes, foi observado que a similaridade ecológica das espécies nesse sistema influencia os padrões de diversidade da comunidade (Mcpeek, 2007). Ou seja, a inserção de novas espécies similares ecologicamente às existentes favorece a biodiversidade por permitirem uma maior frequência de espécies que sejam transitórias na comunidade (i.e., espécies que serão facilmente extintas por causa das interações ecológicas com as espécies com maior similaridade ecológica que seriam mais adaptadas às condições bióticas e abióticas do sistema) (Mcpeek, 2007).
Além disso, a dispersão influencia a dinâmica de uma comunidade a depender do tamanho e composição da comunidade de origem dos dispersores e da estruturação da comunidade de “destino” (Vellend, 2010). Por exemplo, a dispersão pode transferir os efeitos da heterogeneidade na escala regional para a escala local e com isso, permitir que espécies que só coexistiam regionalmente também coexistam localmente quando as comunidades são abertas e consequentemente, um possível aumento de diversidade (Mouquet & Loreau, 2003). Entretanto, níveis altos de dispersão entre manchas podem levar a uma homogeneização progressiva da metacomunidade (Mouquet & Loreau, 2003). Trazendo tais compreensões desses processos descritos em uma dinâmica de comunidades, é possível observar que há uma forte relação entre o espaço físico ocupado pelas espécies com as dinâmicas que ali ocorrem, como a disposição de habitats em manchas e as interações entre espécies. Especificamente, a urbanização tem sido considerada como uma das maiores formas de reorganização e alteração espacial. Desse modo, podemos assumir que atualmente há uma condição antrópica que afeta o arranjo das comunidades que tanto habitam áreas urbanas como aquelas que não habitam, mas são influenciadas pela urbanização.
E o que muda das proposições de uma teoria geral baseada nos quatro processos descritos anteriormente para um cenário urbano? Primeiramente, é necessário compreender duas sugestões para estruturação de comunidades em ambientes urbanos: comunidades auto-organizadas e comunidades de organização facilitada. As comunidades auto-organizadas se estruturam principalmente de acordo com os diferentes filtros ambientais decorrentes das alterações antropogênicas da paisagem urbana; comunidades de organização facilitada são aquelas estruturadas principalmente pelos seres humanos, reunindo intencionalmente espécies em uma determinada localização (e.g., jardins, hortas urbanas e restauração) (Swan et al., 2011). Quando trazemos os quatros processos (seleção, deriva, especiação e dispersão) para essas categorias de comunidades ecológicas urbanas, podemos compreender que o contexto de filtros ambientais impostos pela urbanização são complementares ao processo de seleção definido pela teoria geral, uma vez que impõe condições determinísticas a serem superadas em detrimento de uma aptidão (Silva et al., 2016).
Tomando como exemplo as comunidades facilitadas, o processo de deriva deve ocorrer em função das ações antrópicas de manejo do habitat naquela comunidade juntamente com as condições bióticas e abióticas impostas. Possivelmente, o processo de especiação seja o mais incerto e difícil de ser compreendido nesse contexto, pois parece haver mais fatores regulatórios que envolvem a supressão das espécies devido às ações antrópicas do que criação de novas espécies (McKinney, 2008). Entretanto, a dispersão pode ser mais bem compreendida, pois ela pode ser guiada pelo homem, tanto pelo transporte físico como pelo estabelecimento facilitado da espécie, como no caso de instalação de ninhos de abelha em áreas urbanas como estratégia de resgate do fluxo entre espécies de polinizadores em cidades (Arena et al., 2023). Outra consequência oriunda da dispersão é a homogeneização da comunidade quando espécies altamente dispersoras e adaptadas aos distúrbios decorrentes da urbanização dominam a estruturação da comunidade em áreas urbanas (Wilke et al., 2021).
Em cidades, as áreas verdes, podem servir como habitat para diversos insetos nativos prestadores de importantes serviços ecossistêmicos, como a polinização. Esse serviço possibilita a manutenção da diversidade de plantas que agregam ao consumo humano, além de oferecer conforto climático, ambiental e estético nas cidades (Marselle et al., 2021). Especificamente, o cenário atual de declínio dos polinizadores coloca em destaque a compreensão do estado de conservação das comunidades de abelhas nas áreas urbanas (Goulson et al., 2015). Ao olhar para as cidades ecologicamente, observa-se um contexto de ecossistemas com distúrbios frequentes, alta heterogeneidade de recursos e fortemente dinâmicos (Cadenasso & Pickett, 2008). Desse modo, os possíveis filtros ambientais que ocorrem nesses habitats influenciam na presença de espécies mais adaptadas às cidades como Nannotrigona testaceicornis (abelha Iraí) e Partamona helleri (abelha boca de sapo) quando comparadas as outras espécies de abelhas exclusivamente residentes de áreas nativas (Sousa et al., 2002). Entretanto, para além do levantamento de biodiversidade de abelhas em cidades, é fundamental compreender quais os possíveis fatores permitem a coexistência dessas espécies. Ou seja, como o arranjo dos habitats na paisagem urbana afeta a dispersão entre comunidades de abelhas? Tal dispersão é influenciada por filtros ambientais impostos pela urbanização? Em escala local, como as comunidades de abelhas se relacionam com o manejo das áreas verdes e a distribuição intencional dos recursos nesses espaços? Esses são questionamentos que permeiam minha atividade científica sob o olhar da teoria geral de ecologia de comunidades, cuja proposta maior é garantir a permanência da natureza em espaços que tradicionalmente são hostis a ela.
Referências Bibliográficas
Arena, M. V. N., Toppa, R. H., Martines, M., & Alves-dos-Santos, I. (2023). Release experiments as an indicator of flying activities of stingless bees in urban areas. Frontiers in Sustainable Cities, 4, 196. https://doi.org/10.3389/FRSC.2022.1103835/BIBTEX
Cadenasso, M., & Pickett, S. (2008). Urban Principles for Ecological Landscape Design and Maintenance: Scientific Fundamentals. Cities and the Environment (CATE), 1(2). https://digitalcommons.lmu.edu/cate/vol1/iss2/4
Chesson, P. (2000). Mechanisms of Maintenance of Species Diversity. Annual Review of Ecology and Systematics, 31, 343–366. https://doi.org/10.1146/ANNUREV.ECOLSYS.31.1.343
Goulson, D., Nicholls, E., Botías, C., & Rotheray, E. L. (2015). Bee declines driven by combined Stress from parasites, pesticides, and lack of flowers. Science, 347(6229). https://doi.org/10.1126/SCIENCE.1255957/ASSET/25ACDBB7-03E0-4D87-BEC1-0935B850C29F/ASSETS/GRAPHIC/347_1255957_FA.JPEG
Marselle, M. R., Lindley, S. J., Cook, P. A., & Bonn, A. (2021). Biodiversity and Health in the Urban Environment. Current Environmental Health Reports, 8(2), 146–156. https://doi.org/10.1007/S40572-021-00313-9/METRICS
McKinney, M. L. (2008). Effects of urbanization on species richness: A review of plants and animals. Urban Ecosystems, 11(2), 161–176. https://doi.org/10.1007/S11252-007-0045-4/TABLES/9
Mcpeek, M. A. (2007). The Macroevolutionary Consequences of Ecological Differences Among Species. Palaeontology, 50(1), 111–129. https://doi.org/10.1111/J.1475-4983.2006.00616.X
Mouquet, N., & Loreau, M. (2003). Community patterns in source-sink metacommunities. The American Naturalist, 162(5), 544–557. https://doi.org/10.1086/378857
Roughgarden, J. (2009). Is there a general theory of community ecology? Biology and Philosophy, 24(4), 521–529. https://doi.org/10.1007/S10539-009-9164-Z/METRICS
Silva, C. P., Sepúlveda, R. D., & Barbosa, O. (2016). Nonrandom filtering effect on birds: species and guilds response to urbanization. Ecology and Evolution, 6(11), 3711–3720. https://doi.org/10.1002/ECE3.2144 Sousa, L. A., Thatiana, Pereira, O., Prezoto, F., Georgina., & Faria-Mucci, M. (2002). Nest Foundation and Diversity of Meliponini (Hymenoptera, Apidae) In an Urban Area of The Municipality Of Juiz De Fora, Mg, Brazil. Bioscience Journal, 18(2), 59–65. https://seer.ufu.br/index.php/biosciencejournal/article/view/6420
Swan, C. M., Pickett, S. T. A., Szlavecz, K., Warren, P., & Willey, K. T. (2011). Biodiversity and Community Composition in Urban Ecosystems: Coupled Human, Spatial, and Metacommunity Processes. In Urban Ecology: Patterns, Processes, and Applications (pp. 179–186). Oxford University Press. https://doi.org/10.1093/ACPROF:OSO/9780199563562.003.0021
Vellend, M. (2010). Conceptual Synthesis in Community Ecology. The Quarterly Review of Biology, 85(2), 183–206. https://doi.org/10.1086/652373
Wilke, A. B. B., Vasquez, C., Carvajal, A., Moreno, M., Fuller, D. O., Cardenas, G., Petrie, W. D., & Beier, J. C. (2021). Urbanization favors the proliferation of Aedes aegypti and Culex quinquefasciatus in urban areas of Miami-Dade County, Florida. Scientific Reports 2021 11:1, 11(1), 1–12. https://doi.org/10.1038/s41598-021-02061-0
Redução de danos em ecossistemas aquáticos: a redundância funcional e o seguro da biodiversidade
Déborah Maria de Oliveira
Como bem sabemos das aulas, “trade-offs são pervasivos na natureza”, destarte a dinâmica das comunidades flutua buscando equilíbrios, de modo que certos aspectos aparentemente negativos a um indivíduo ou população são “compensados” por trazerem outras vantagens no panorama geral. Os estados estáveis oferecem certa resistência a distúrbios, o que chamamos de resiliência, e podem ser recuperados até certo ponto através de mecanismos autorregulados (BLINDOW et al., 1993). Esse nível de plasticidade pode variar entre uma comunidade e outra conforme os atributos das espécies presentes e como estas se relacionam com as diferentes escalas, sejam elas local, regional, temporal, etc. (PETERSON et al., 1998). De acordo com Peterson et al. (1998), Charles Darwin foi pioneiro ao inferir que maior diversidade de espécies resultaria em um sistema mais estável, entretanto hoje percebemos que é infrutífero pensarmos em diversidade per se, sem nos atentarmos às consequências e possibilidades trazidas pela quantidade de espécies. Isso porque a taxonomia não anda sozinha - todas as espécies possuem atributos de nicho e função, interagem com outras, com o ambiente e dentro da própria população. Assim sendo, podemos compreender melhor o ambiente que nos cerca ao incluirmos no termo biodiversidade número e composição de genótipos, espécies, tipos funcionais e unidades de paisagem (ou seja, espaço geográfico) que compõem um sistema (DÍAZ & CABIDO, 2001).
Os atributos funcionais podem ser comuns para organismos taxonomicamente próximos por manutenção de caracteres evolutivos e conservadorismo de nicho, por exemplo (BLOMBERG et al., 2001 apud VOGT et al., 2013), mas isso não implica que espécies parecidas sempre desempenham as mesmas funções ecológicas, tampouco que o crescimento ou decréscimo da diversidade taxonômica acompanha a diversidade funcional (DÍAZ & CABIDO, 2001; VOGT at al., 2010). Os estudos de diversidade funcional em diversas esferas da ecologia podem favorecer o entendimento dos sistemas biológicos e a importância da conservação das espécies, ao entendermos não apenas seus aspectos quantitativos, como também os qualitativos, a título de exemplo, como afetam a dinâmica de recursos a curto prazo, e a estabilidade de sistemas a longo prazo (DÍAZ & CABIDO, 2001). Loreau et al. (2021) discorrem sobre termos existentes na Economia e na Ecologia que conceitualmente apresentam muitos pontos de convergência, afinal ambas as ciências se dedicam ao estudo da nossa oikos (“casa”, em Grego, uma referência ao planeta no qual vivemos). Cabe destacar dois conjuntos de termos discutidos pelos autores: evitação de catástrofes e efeito de complementaridade, com seus respectivos correspondentes da Economia, seguro/garantia e diversificação econômica. Também é central ao debate sobre diversidade funcional e ecossistêmica o conceito de redundância funcional (DÍAZ & CABIDO, 2001).
Começando de trás para frente, Díaz & Cabido (2001) trazem o conceito da área da Engenharia de fiabilidade, ou segurança, para explicar o que seria a redundância funcional: se muitos componentes operam a mesma função dentro de um sistema, sua confiabilidade é maior, uma vez que o impacto geral será pouco relevante caso um dos componentes esteja faltando ou falhe na sua função. Nesse contexto, os autores descrevem a redundância funcional como uma política de garantia: caso haja um desequilíbrio, é bem possível que algumas das espécies sobrevivam e aquela função não seja perdida, ajudando na manutenção do estado de equilíbrio; essa explicação tem pontos em comum com o que Loreau et al. (2021) chamam de evitação de catástrofes. Outra perspectiva da hipótese do seguro está associada à ideia de que grande diversidade funcional resulta em mais organismos sendo capazes de sobreviver a condições diversas, aumentando a capacidade tampão do sistema (DÍAZ & CABIDO, 2001). Por fim, o efeito de complementaridade, como o termo sugere, implica em melhor performance de espécies quando estão em um mesmo sistema - seja por ocuparem nichos diferentes ou por executarem uma mesma funcionalidade de maneira distinta - do que quando atuam separadamente (LOREAU et al., 2021).
De acordo com Barnett et al. (2007), ampliar os conhecimentos sobre a estruturação funcional em ambientes aquáticos possibilita também prevermos como o sistema se porta frente a distúrbios e variações naturais em seus estados estáveis. Há diversos modos de se medir a diversidade funcional, e a separação de grupos funcionais em comunidades é arbitrária, dependendo do estudo que se realiza, os objetivos, a escala que se estuda, os organismos envolvidos, entre outros aspectos (DÍAZ & CABIDO, 2001; BARNETT et al., 2007; SCHLEUTER et al., 2010; VOGT et al., 2010). Para organismos zooplanctônicos dulcícolas é possível agrupar as espécies considerando características como: tamanho, mobilidade, hábitat de vida, capacidade de escape de predadores, estratégias nutricionais e tamanho do alimento que consomem (BARNETT et al., 2007; OBERTEGGER et al., 2010; VOGT et al., 2013; LITCHMAN et al., 2013; MOREIRA et al., 2016; BRAGHIN, 2019).
Braghin (2019) escreve que é mais provável que ambientes heterogêneos comportem maior diversidade funcional, e que os atributos funcionais se combinem de maneira distinta entre as populações desse sistema. Com base em tabelas e produções acadêmicas como dessa autora, a equipe do Laboratório de Ecologia Aquática, Evolução e Conservação da Universidade Federal de Ouro Preto (LAECO-UFOP) organizou as espécies encontradas no monitoramento do baixo Rio Doce (dados de novembro de 2018 a setembro de 2019 da Rede Rio Doce-Mar) em oito grupos funcionais distintos, para compreender suas relações com o tipo de ambiente (lago ou lagoa) e com os poluentes detectados nas análises químicas de água e sedimento. Foi observada correlação negativa de riqueza funcional de zooplâncton com carbono orgânico total, nitrogênio total, ferro e manganês; enquanto a correlação foi positiva com equitabilidade funcional, clorofila-α e quatro dos oito grupos funcionais. Aqui também é importante citar a equitabilidade funcional, que se refere ao espaço funcional ocupado pelas espécies com relação a sua abundância relativa (SANTOS, 2021). Nos estudos do LAECO foi percebida maior equitabilidade funcional em lagos, indicando que, além de ter maior quantidade de funções sendo executadas pelo zooplâncton, os lagos amostrados da bacia do Rio Doce também apresentam distribuição mais similar de espécies compondo os diferentes grupos.
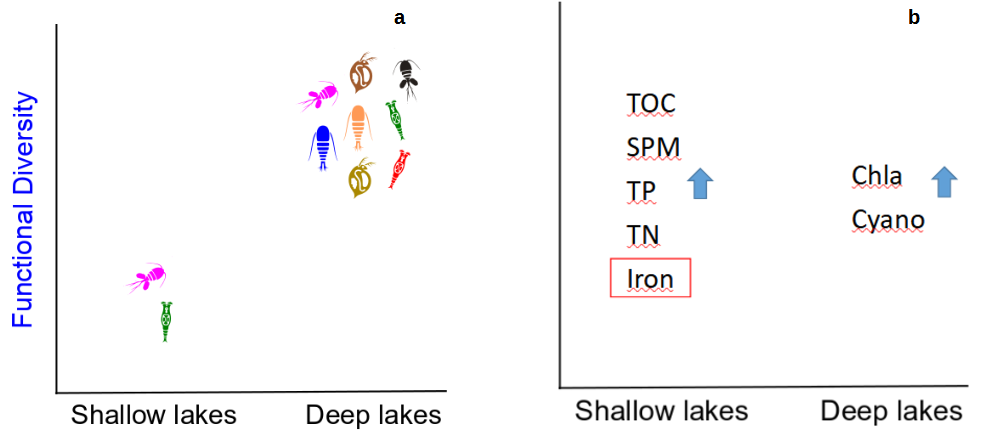 Figura 1 - Diversidade funcional (gráfico a) e compostos mais presentes nas amostras (gráfico b), comparando lagos (“deep lakes”) e lagoas (“shallow lakes”) (SANTOS, 2021). Os dados sugerem maior complexidade de hábitat em lagos do que em lagoas, através da percepção de uma maior diversidade de funções. O que observamos para lagoas pode ser um retrato da hipótese do seguro na evitação de catástrofe, com menor diversidade funcional sendo exercidas pelas espécies quando o sistema está sob estresse. As siglas no gráfico b indicam: TOC - carbono orgânico total, SPM - material particulado em suspensão, TP - fósforo total, TN - nitrogênio total, Iron - ferro dissolvido, Chla - clorofila-α e Cyano - densidade de cianobactérias.
Figura 1 - Diversidade funcional (gráfico a) e compostos mais presentes nas amostras (gráfico b), comparando lagos (“deep lakes”) e lagoas (“shallow lakes”) (SANTOS, 2021). Os dados sugerem maior complexidade de hábitat em lagos do que em lagoas, através da percepção de uma maior diversidade de funções. O que observamos para lagoas pode ser um retrato da hipótese do seguro na evitação de catástrofe, com menor diversidade funcional sendo exercidas pelas espécies quando o sistema está sob estresse. As siglas no gráfico b indicam: TOC - carbono orgânico total, SPM - material particulado em suspensão, TP - fósforo total, TN - nitrogênio total, Iron - ferro dissolvido, Chla - clorofila-α e Cyano - densidade de cianobactérias.
Felizmente hoje em dia temos muitas informações documentadas a respeito da caracterização do zooplâncton tropical e temperado, porém ainda é necessário ampliar a caracterização dos aspectos funcionais das espécies conhecidas. Por ora seguimos sem uma regra única para o agrupamento funcional das espécies, e o conhecimento da relação dessas funções com a manutenção e estabilidade dos sistemas ainda está em construção. Apesar de ter participado de pesquisas sobre a diversidade funcional no LAECO, ainda me faltava assimilar como a resiliência e a dinamicidade dos sistemas se vinculam à dinâmica das espécies, e a maneira que seus atributos funcionais podem moldar os sistemas estudados. Ao final da disciplina de Ecologia de Comunidades vejo que os próximos passos são promissores: compreendendo quais leis ou hipóteses melhor regem a dinâmica de lagos e lagoas que foram afetados por rejeito de mineração na bacia do Rio Doce é possível evitar ou minimizar a perda de espécies que realizam funções ecológicas ímpares em seus respectivos ambientes, possibilitando contornar a variação dos estados de equilíbrio e reforçar o tamponamento dos estados estáveis. Tal compreensão pode parecer pouco significativa, mas os organismos zooplanctônicos são elos essenciais nas cadeias tróficas - quanto mais os conhecemos, melhor entendemos os ambientes aquáticos como um todo.
Referências bibliográficas
BARNETT, A. J., FINLAY, K. & BEISNER, B. E. 2007. Functional diversity of crustacean zooplankton communities: towards a trait-based classification. Freshwater Biology, 52, 796-813. https://doi.org/10.1111/j.1365-2427.2007.01733.x
BLINDOW, I., ANDERSSON, G., HARGEBY, A. & JOHANSSON, S., 1993. Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology, 30, 159-167. https://doi.org/10.1111/j.1365-2427.1993.tb00796.x
BRAGHIN, L. S. M. 2019. Estruturação funcional do zooplâncton no espaço e no tempo em uma planície de inundação Neotropical. Tese de Doutorado, Programa de Pós-Graduação em Ecologia de Ambientes Aquáticos Continentais do Departamento de Biologia, Centro de Ciências Biológicas da Universidade Estadual de Maringá, 83 p. http://repositorio.uem.br:8080/jspui/handle/1/6813
DÍAZ, S. & CABIDO, M., 2001. Vive la différence: plant functional diversity matters to ecosystem processes. Trends in Ecology & Evolution, 16(11), 646-655. https://doi.org/10.1016/S0169-5347(01)02283-2
LITCHMAN, E; OHMAN, M. D. KIØRBOE, T. 2013. Trait-based approaches to zooplankton communities. Journal of Plankton Research, 35(3), 473–484. https://doi.org/10.1093/plankt/fbt019
LOREAU, M., BARBIER, M., FILOTAS, E., GRAVEL, D. , ISBELL, F., MILLER, S. J., MONTOYA, J. M., WANG, S., AUSSENAC, R., GERMAIN, R., THOMPSON, P. L., GONZALEZ, A. & DEE, L. E. 2021. Biodiversity as insurance: from concept to measurement and application. Biological Reviews, 96, 2333-2354. https://doi.org/10.1111/brv.12756
MOREIRA, F. W. A.; LEITE, M. G. P.; FUJACO, M. A. G.; MENDONÇA, F. P. C.; CAMPOS, L. P. & ESKINAZI-SANT’ANNA, E. M. F. 2016. Assessing the impacts of mining activities on zooplankton functional diversity. Acta Limnologica Brasiliensia, 28(7). https://doi.org/10.1590/S2179-975X0816
OBERTEGGER, U.; SMITH, H. A.; FLAIM, G. & WALLACE, R. L. 2010. Using the guild ratio to characterize pelagic rotifer communities. Hydrobiologia, 662, 157-162. https://doi.org/10.1007/s10750-010-0491-5
PETERSON, G., ALLEN, C. R. & HOLLING, C. S. Ecological resilience, biodiversity, and scale. 1998. Ecosystems, 01, 06-18. https://doi.org/10.1007/s100219900002
SANTOS, G. S. 2021. Resultados preliminares de diversidade funcional do zooplâncton de lagos e lagoas da RRDM. Dados e gráficos ainda não publicados. Apresentação de slides e documentos produzidos por Santos, além de comentários redigidos em anotações pessoais minhas durante reuniões do LAECO em março e abril de 2021.
SCHLEUTER, D.; DAUFRESNE, M. ;MASSOL, F. & ARGILLIER, C. 2010. A user’s guide to functional diversity indices. Ecological Monographs, 80(3), 469–484. https://doi.org/10.2307/20787442
VOGT, R. J., BEISNER, B. E. & PRAIRIE, Y. T. 2010. Functional diversity is positively associated with biomass for lake diatoms. Freshwater Biology, 55, 1636-1646. https://doi.org/10.1111/j.1365-2427.2010.02397.x
VOGT, R. J., PERES-NETO, P. R. & BEISNER, B. E. 2013. Using functional traits to investigate the determinants of crustacean zooplankton community structure. Oikos, 122, 1700-1709. https://doi.org/10.1111/j.1600-0706.2013.00039.x
Resiliência no manejo pesqueiro
Maria Luiza Leal de Paula
O conceito de resiliência surge em meio às tentativas de explicações dos comportamentos dos sistemas quanto ao seu equilíbrio e estabilidade, ou a falta destes, considerando principalmente os eventos estocásticos que podem levar ao desaparecimento e reaparecimento de espécies, e a relação dessas transformações com a ação humana. Consiste na capacidade de um sistema de enfrentar um distúrbio e persistir sem mudanças nas suas variáveis de estado (Holling, 1973; Scheffer, 2009). Quanto maior for a perturbação necessária para promover a mudança do estado original desse sistema, maior é a resiliência. Contudo, podem ocorrer transformações graduais que fragilizam o sistema diminuindo a resiliência do mesmo e o tornando mais vulnerável à mudança do estado original por consequência de eventos estocásticos (Scheffer, 2009). A sensibilidade às perturbações pode ser atenuada pelo aumento da riqueza de espécies em uma comunidade, como primeiro proposto por MacArthur (1955) e Elton (1958), o que conduz a hipótese conhecida como insurance hypothesis que propõe que ecossistemas diversos têm maiores chances de manter uma estabilidade funcional se muitas espécies o habitarem (Loreau et al., 2021; Schindler et al., 2015; Yachi e Loreau, 1999).
A construção desses conceitos se estruturou em meio ao conflito entre ver o mundo em situação de equilíbrio ao redor de um estado ou explorando os limites de atração a um determinado estado. O comportamento de estabilidade de um sistema se mostra pela habilidade do mesmo de retomar um equilíbrio após um distúrbio, de modo que maior é a estabilidade conforme menor for a flutuação. Por outro lado, a resiliência se dá na instabilidade, na capacidade de persistir em um estado apesar de flutuações significativas (Holling, 1973). Essa segunda perspectiva é mais razoável para ser considerada nas medidas de manejo, por corresponder com maior proximidade a realidade do comportamento dos sistemas. Isso, atrelado a dificuldade de manejar a ocorrência de perturbações estocásticas, faz com que a resiliência dos ecossistemas e comunidades seja o objetivo de estratégias de manejo promissoras (Holling,1973 e Scheffer, 2009).
Ademais, com o desenvolvimento da ideia de que maior biodiversidade proporciona maior resiliência, passou-se a considerar também as diferenças nas respostas das espécies frente aos distúrbios no ambiente (Yachi e Loreau, 1999). Esse ponto entrelaça a insurance hypothesis ao chamado efeito de portfólio, que considera vantajoso apresentar um pool de espécies diferentemente impactadas pelas mudanças no meio bem como é importante manter um portfólio de investimento em diferentes ações no mercado financeiro, do qual esse conceito se baseou (NOAA, 2018; Schindler et al., 2015). Doak et al (1998) pôde confirmar, a partir dos dados de um experimento de Tilman e Downing (1994), que o número de espécies presentes em um sistema era negativamente correlacionado a magnitude de um distúrbio em uma comunidade simplesmente devido a variação assincrônica das espécies ao longo do tempo (Loreau et al., 2021; Schindler et al., 2015). Assim, a contribuição de algumas espécies pode aumentar enquanto a de outras diminui, e a compensação entre essas diminui a variabilidade de estados do sistema (Loreau et al., 2021; Yachi e Loreau, 1999).
As atividades pesqueiras têm reduzido a resiliência dos sistemas e levado ao colapso de populações que enfrentaram eventos estocásticos impactantes. Porém, extinções não são completamente aleatórias, já que resultam da interação entre esses eventos catastróficos e os vieses determinísticos que qualificam a atração ao estado de origem. Dessa forma, é possível mudar a parte determinística do processo, evitando a perda de resiliência que possibilita a resistência às mudanças, o que pode ser feito ao manter a biodiversidade (Holling, 1973). Áreas de proteção ambiental marinhas são uma boa estratégia para assegurar a diversidade através da dispersão de larvas desses ambientes a outros mais explorados. As variações nos padrões de recrutamento, influenciados por processos oceanográficos e pelo comportamento das larvas, pode ser atenuada através da contribuição de mais de uma reserva marinha, criando um efeito de portfólio no fornecimento de peixes juvenis para áreas adjacentes (Harrison, 2020).
Tal efeito é também presenciado pelos próprios pescadores, bem como para os demais predadores de peixes, de modo que o portfólio os propõe maiores chances de encontrar alvos de captura e, portanto, diminui os riscos de colapso de uma espécie (NOAA, 2018; Schindler et al., 2015). Essa estratégia de pesca multiespecífica também reduz a variabilidade dos lucros dos pescadores (Loreau et al., 2021). Um estudo com pescadores artesanais na Colômbia testou essa medida de manejo e concluiu que a diversificação na captura permite que as gerações de pescadores mantenham seus modos de vida mesmo em um ambiente que está mudando; e estudos recentes na América do Norte mostraram que a diversificação diminuiu a variação de lucros anuais. A flutuação assincrônica das espécies alvo permite tal resiliência, mas o modo de captura é o que determinará a diversificação da pesca através das escolhas das redes, já que o pescador não possui completo controle das espécies incluídas no portfólio. As redes não seletivas são as que mantêm esse objetivo independentemente das condições ambientais (Vargas et al., 2022).
O modo de vida intrinsecamente atrelado aos recursos naturais torna esses pescadores, principalmente artesanais e de pequena escala, vulneráveis às catástrofes naturais, pondo em cheque tanto sua segurança monetária quanto alimentar. Há evidências de que os preços dos pescados também variam de modo assíncrono, magnificando o efeito de portfólio (Vargas et al., 2022). Entretanto, é preciso ressaltar que os benefícios das pescarias de alvos diversificados não são universais, dado que podem acontecer percalços em meio a ecologia e economia desse sistema, o que pode desencorajar essa medida e promover a especificidade das capturas (Loreau et al., 2021). Apesar disso, um manejo baseado em resiliência dá ênfase para a necessidade de se considerar a estocasticidade envolta nessa atividade, bem como a heterogeneidade. Assim, não se reconhece através do conhecimento, mas promove-se ao reconhecer a ignorância e incerteza dos eventos futuros (Holling, 1973).
Referências bibliográficas
Elton, C. S. 1958. The ecology of invasions by animals and plants. New York, NY: Chapman & Hall.
Harrison, H. B.; Bode, M.; Williamson, D. H.; Jones, G. P. 2019. A connectivity portfolio effect stabilizes marine reserve performance. PNAS. 117 (41). 25595-25600.
Holling, C.S. 1973. Resilience and stability of ecological systems. Annu. Rev. Ecol. Syst. 4: 1-23.
Loreau M.; Barbier, M.; Filotas, E.; Gravel, D.; Isbell, F.; Miller, S. J.; Montoya, J. M.; Wang, S.; Aussenac, R.; Germain, R.; Thompson, P. L.; Gonzalez, A.; Dee, L. E. 2021. Biodiversity as insurance: from concept to measurement and application. Biological Reviews. Cambridge Philosophical Society. Vol. 96. 2333-2354.
MacArthur, R. H. 1955. Fluctuations of animal populations, and ameasure of community stability. Ecology. 36: 533–36
NOAA. 2018. The Portfolio Effect: Where Diversity Matters in Marine Fisheries. Disponível em: < https://www.fisheries.noaa.gov/feature-story/portfolio-effect-where-diversity-matters-marine-fisheries#:~:text=This%20approach%20is%20known%20as,market%20or%20dynamic%20marine%20ecosystem>.
Scheffer, M. 2009. Alternative Stable States. In: Critical Transitions in Nature and Society. Chapter 2: 11-36, Princenton University Press.
Schindler, D. E.; Armstrong, J. B.; Reed, T. E. 2015. The portfolio concept in ecology and Evolution. Front. Ecol. Environ. 13(15). 257-263.
Vargas, A.; Restrepo, S.; Diaz, D. 2022. The portfolio effect in a small-scale fishery reduces catch and fishing income variability in a highly dynamic ecosystem. PLoS ONE 17(8).
Yachi, S.; Loreau, M. 1999. Biodiversity and ecosystem productivity in a fluctuating environment: The insurance Hypothesis. Proc. Natl. Acad. Sci. Vol. 96. 1463-1468.
A Paisagem do medo e como ela pode potencialmente afetar a evolução da reotaxia em peixes poeciliídeos
Alan Contri Villapando
Sabe-se que a predação é um dos mecanismos de seleção que estruturam comunidades (Vellend 2010). A perspectiva clássica sobre os efeitos da predação sobre as presas diz simplesmente que os predadores as matam, removendo-as das populações e gerando um efeito mediado pela densidade, porém sabe-se que predadores também induzem um stress psicológico e geram mudanças comportamentais em suas vítimas, como fazendo-as fugir e buscar refúgio, sendo esses efeitos mediados pelo atributo (Schmitz et al 2004). Há evidências de que esses efeitos mediados pelo atributo podem afetar a demografia das presas até mais do que o efeito da remoção das presas pelo predador (Preisser et al 2005). O conjunto dessas mudanças induzidas pela intimidação junto com os efeitos ecológicos resultantes dessas interações é chamada de ecologia do medo (Brown et al 1999). Os predadores podem ser aptos em tipos diferentes de hábitat (Laudré et al 2010, Bergman et al 2006), logo os riscos de predação não estão homogeneamente distribuídos no espaço e no tempo (Zanette e Clinchy 2019, Bergman et al 2006), e assim isso acaba gerando a Paisagem do Medo, que é descrita como a variação espacial e temporal na percepção de uma presa sobre o risco de predação em um ambiente (Laundré et al 2001), como se a presa tivesse um mapa mental do seu ambiente, destacando as áreas de risco (Laudré et at 2010) (Fig 1). Esse conceito parte do pressuposto de que uma presa sabe dos riscos de predação no seu meio, seja por instinto ou por aprendizado (Laundré et al 2010).
Figura 1 - Representação visual da Paisagem do medo, onde X e Y representam as coordenadas do local e o eixo Z representa o nível do risco de predação. Extraído de Laundré et al 2010
Antes da expressão Paisagem do Medo ser cunhada por Laundré et al (2001), havia ecólogos comportamentais realizando estudos buscando entender o efeito da predação sobre o comportamento das presas (Gaynor et al 2019). Por exemplo, Charnov et al (1976) cunharam o termo “depressão comportamental de recursos” para se referir a situações onde uma presa realiza mudanças de microhabitat na presença de predadores. Também já havia evidências que um animal deve avaliar riscos ao forragear, ou seja, buscar alimento (Sih 1980). O que o modelo de paisagem do medo faz é amalgamar os trabalhos anteriores em um modelo físico da paisagem, e também assume que os diferentes riscos de predação podem ser quantificados (Laundré et al 2010). Experimentos de manipulação mostram que presas assustadas forrageiam menos (Beckerman et al 1997) e têm menor aptidão reprodutiva (Grade et al 2021). Dessa forma, ocorre um trade-off onde há redução em alimentação e/ou sucesso reprodutivo, porém aumento em segurança individual (Grade et al 2021). Logo, a distribuição espacial das presas é afetada por decisões de forrageamento e de evitar predadores, e essa distribuição tem efeitos em cascata em processos da comunidade e do ecossistema (Beschta e Ripple 2009).
A presença de um predador em um ecossistema leva um efeito conhecido como cascata trófica, processo descrito por Paine (1980) onde quem está abaixo da presa na pirâmide alimentar é beneficiado, e esse efeito se propaga pela teia alimentar (Carpenter et al 1985). Esse efeito é do tipo top-bottom, pois parte dos níveis tróficos superiores para os inferiores. Em um ambiente onde as presas são afetadas pela paisagem do medo, as presas obtém menor aptidão e seus números diminuem, dessa forma ocorre a cascata trófica (Ripple e Bestchta 2011). Além disso as presas, como animais herbívoros por exemplo, acabam por evitar certas áreas onde há maior risco de predação e assim a comunidade vegetal nessas áreas é reestruturada (Halofsky e Ripple 2008b), com plantas podendo crescer mais e até mais espécies podem ser atraídas para o local, logo, a paisagem do medo influencia na estrutura da comunidade, mas também a estrutura do hábitat (Ripple e Bescha 2011) e até processos ecossistêmicos (Ripple e Beschta 2004a), como a ciclagem de nutrientes (Hawlena 2012, Frank 2008). Contudo, é importante salientar que a cascata trófica pode ocorrer em decorrência dos efeitos mediados pelo atributo, mas também pelos efeitos mediados pela densidade, logo ao observar uma cascata trófica, pode ser difícil distinguir qual efeito da predação está ocorrendo com mais impacto, de consumo ou mediado por atributo (Schmitz et al 2004). Para se ter uma ideia do processo, deve-se simular um ambiente de predação, sem o predador matar a presa (Smitz et al 2004) e assim avaliar as respostas comportamentais da presa, sua aptidão e os efeitos no ecossistema. Experimentos de manipulação em pequenas escalas são mais fáceis de serem realizados, como por exemplo impedir a predação colando as partes bucais do predador (Beckerman et al 1997), ou utilizar os odores do predador (Peckarsky e McIntosh 1998). Mas em largas escalas pode-se simular a vocalização de um predador que está ausente usando caixas de som (Grade et al 2021). Também ao reintroduzir um carnívoro em uma área onde previamente havia sido extinta, para ter mais informações a respeito da subsequente cascata trófica e saber mais sobre as respostas das presas à chegada dos predadores, pode-se analisar se ocorrem mudanças comportamentais da presa (Halofsky e Ripple 2008a) e se há mudanças do uso de hábitat (Mao et al 2005), por exemplo rastreando os movimentos dos herbívoros com GPS (Fortin et al 2005).
Dentro dessa perspectiva, um tema para investigação futura é como a paisagem do medo influencia a evolução da reotaxia em peixes, que é um comportamento consiste em um peixe se manter em posição na corrente de água ou se orientar contra ela (Northcutt 1997). Na minha pesquisa estou estudando sobre peixes poeciliídeos e suas histórias de vida, que são seus padrões de crescimento, desenvolvimento e reprodução (Begon et al 2006). Um dos fatores que influenciam na evolução de histórias de vida é a predação (Reznick et al 1990), e isso me fez pensar mais a respeito de como a predação afeta os organismos. Estudos já foram feitos sobre como disponibilidade de alimento e quantidade de predadores podem influenciar nos comportamentos dos peixes, como decisões ótimas de forrageamento, escolha de locais de abrigo e sua distribuição no habitat (Gillian e Fraser 1987, Power 1984). Os peixes da família Poeciliidae são muito utilizados em estudos de ecologia e evolução (Magurran 2005) e também podem ser utilizados em estudos sobre a ecologia do medo (Polverino et al 2022) e apesar de pequenos, também podem apresentar reotaxia (Blondel et al 2020). Um experimento poderia consistir de comparar riachos com condições físico-químicas semelhantes, e a diferença principal entre eles seria a intensidade da predação, e assim analisar se os predadores influenciam a distribuição dos peixes e sua dispersão riacho acima. Sabe-se que o comportamento de reotaxia tem componentes genéticos (Jonsson 1982), e assumindo que peixes que percebem mais os predadores e que busquem se dispersar para se afastar mais deles teriam mais aptidão, logo podemos prever que a paisagem do medo pode influenciar peixes a procurarem mais locais de abrigo e colonizar novos ambientes, incluindo nadar contra a corrente, assim peixes com maior reotaxia seriam favorecidos pela seleção natural.
Para fazer tal pesquisa, primeiramente poderia ser feita uma seleção de dois riachos semelhantes em condições abióticas como largura, oxigênio dissolvido, temperatura e fluxo da corrente e onde ocorrem poeciliídeos, e o que difere entre eles seria a abundância de predadores, onde um teria maior abundância que o outro, ou mais espécies de predadores que o outro. Assim, um experimento de captura, marcação e recaptura seria feito para avaliar a capacidade de dispersão de ambas as populações de peixes correnteza acima, e também realizar um teste de reotaxia em um tanque de circulação circular assim como visto em Jiang et al (2015) e Blondel et al (2020). Assumindo que no sistema onde há maior predação fosse confirmado que os peixes se dispersam mais e apresentam maior reotaxia, não podemos afirmar com certeza que a predação mais alta é o motivo, afinal algo além do risco de predação poderia estar atraindo os peixes riacho acima, como talvez fontes de alimento. Poderia-se então coletar peixes dos dois riachos, fazê-los procriar em laboratório, e os descendentes poderiam então ser marcados e levados a um terceiro riacho com condições semelhantes ao outros, porém com um nível intermediário de predação, assim poderíamos quantificar o nível de dispersão de ambas as populações de peixes e avaliar o papel dos predadores nessa dispersão.
Referências bibliográficas
Beckerman, A.P., Uriarte, M. e Schmitz, O.J., 1997. Experimental evidence for a behavior-mediated trophic cascade in a terrestrial food chain. Proceedings of the National Academy of Sciences, 94(20), pp.10735-10738.
Begon, M., Townsend, C.R., Harper J. 2006. Ecology: from individuals to ecosystems. BlackWell Publishing.
Blondel, L., Klemet-N’Guessan, S., Scott, M.E. e Hendry, A.P., 2020. Asymmetric isolation and the evolution of behaviors influencing dispersal: Rheotaxis of guppies above waterfalls. Genes, 11(2), p.180.
Bergman EJ, Garrott RA, Creel S, Borkowski JJ, JaVe R, Watson FGR 2006 Assessment of prey vulnerability through analysis of wolf movements and kill sites. Ecol Appl 16:273–284
Beschta, R.L. and Ripple, W.J., 2009. Large predators and trophic cascades in terrestrial ecosystems of the western United States. Biological conservation, 142(11), pp.2401-2414.
Brown, J.S., Laundré, J.W. e Gurung, M., 1999. The ecology of fear: optimal foraging, game theory, and trophic interactions. Journal of mammalogy, 80(2), pp.385-399.
Carpenter, S. R., Kitchell, J. F., & Hodgson, J. R. 1985. Cascading trophic interactions and lake productivity. BioScience, 35(10), 634-639.
Charnov, E. Orians G, Hyatt K. 1976. Ecological implications of resource depression. Am. Nat. 110, 247–259
Fortin, D., Beyer, H.L., Boyce, M.S., Smith, D.W., Duchesne, T. e Mao, J.S., 2005. Wolves influence elk movements: behavior shapes a trophic cascade in Yellowstone National Park. Ecology, 86(5), pp.1320-1330.
Frank, D.A., 2008. Evidence for top predator control of a grazing ecosystem. Oikos 117, 1718–1724
Gaynor, K.M., Brown, J.S., Middleton, A.D., Power, M.E. e Brashares, J.S., 2019. Landscapes of fear: spatial patterns of risk perception and response. Trends in ecology & evolution, 34(4), pp.355-368.
Grade, A.M., Lerman, S.B. e Warren, P.S., 2021. Perilous choices: landscapes of fear for adult birds reduces nestling condition across an urban gradient. Ecosphere, 12(7), p.e03665.
Halofsky, J., Ripple, W., 2008a. Fine-scale predation risk on elk after wolf reintroduction in Yellowstone National Park. Oecologia 155, 869–877.
Halofsky, J., Ripple, W., 2008b. Linkages between wolf presence and aspen recruitment in the Gallatin elk winter range of southwestern Montana, USA. Forestry 81, 195–207
Hawlena, D., Strickland, M. S., Bradford, M. A., Schmitz, O. J. (2012). Fear of predation slows plant-litter decomposition. Science, 336(6087), 1434-1438.
Jiang, Y., Torrance, L., Peichel, C.L. e Bolnick, D.I., 2015. Differences in rheotactic responses contribute to divergent habitat use between parapatric lake and stream threespine stickleback. Evolution, 69(9), pp.2517-2524.
Jonsson, B 1982. Diadromous and Resident Trout Salmo trutta: Is Their Difference Due to Genetics? Oikos, 38, 297
Laundré, JW, Hernández, L, Altendorf, KB 2001. Wolves, elk, and bison: reestablishing the “landscape of fear” in Yellowstone National Park, USA. Canadian Journal of Zoology, 79, 1401-1409.
Laundré, J.W., Hernández, L. and Ripple, W.J., 2010. The landscape of fear: ecological implications of being afraid. The Open Ecology Journal, 3(1).
Magurran, A.E., 2005. Evolutionary ecology: the Trinidadian guppy. Oxford University Press on Demand.
Mao, J.S., Boyce, M.S., Smith, D.W., Singer, F.J., Vales, D.J., Vore, J.M., Merrill, E.H., 2005. Habitat selection by elk before and after wolf reintroduction in Yellowstone National Park. Journal of Wildlife Management 69, 1691–1703
Northcutt, R.G., 1997. Swimming against the current. Nature, 389(6654), pp.915-916.
Paine, R.T., 1980. Food webs: linkage, interaction strength and community infrastructure. Journal of Animal Ecology 49, 667–685
Peckarsky, B.L., McIntosh, A.R. 1998. Fitness and community consequences of avoiding multiple predators. Oecologia, 113, 565–576.
Preisser, E.L., Bolnick, D.I. e Benard, M.F., 2005. Scared to death? The effects of intimidation and consumption in predator–prey interactions. Ecology, 86(2), pp.501-509.
Polverino, G., Soman, V.R., Karakaya, M., Gasparini, C., Evans, J.P. e Porfiri, M., 2022. Ecology of fear in highly invasive fish revealed by robots. Iscience, 25(1), p.103529.
Power, M.E., 1984. Depth distributions of armored catfish: predator‐induced resource avoidance?. Ecology, 65(2), pp.523-528.
Reznick, D.A., Bryga, H. e Endler, J.A., 1990. Experimentally induced life-history evolution in a natural population. Nature, 346(6282), pp.357-359.
Ripple, WJ, Beschta, RL 2004a Wolves and the ecology of fear: can predation risk structure ecosystems BioScience, 54, 755-766.
Ripple WJ, Betscha RL 2011.Trophic cascades in Yellowstone:The first 15 years after wolf reintroduction. Biological Conservation 2011;145:205-213
Schmitz, O.J., Beckerman, A.P. e O’Brien, K.M., 1997. Behaviorally mediated trophic cascades: effects of predation risk on food web interactions. Ecology, 78(5), pp.1388-1399.
Schmitz, O.J., Krivan, V. and Ovadia, O., 2004. Trophic cascades: the primacy of trait‐mediated indirect interactions. Ecology letters, 7(2), pp.153-163.
Sih, A. (1980). Optimal behavior: can foragers balance two conflicting demands?. Science, 210(4473), 1041-1043.
Vellend, M., 2010. Conceptual synthesis in community ecology. The Quarterly review of biology, 85(2), pp.183-206.
Zanette, L.Y. and Clinchy, M., 2019. Ecology of fear. Current biology, 29(9), pp.R309-R313.
Alças de feedback positivo e restauração ecológica
Marina Bowkunouvicz Marcon
Sistemas ecológicos dinâmicos têm o seu estado determinado pela resultante de um balanço de processos. Quando esse balanço leva a um equilíbrio estável, o sistema se encontra em estado estável (Scheffer, 2009). Um exemplo de sistema em estado estável é uma população na qual as taxas de natalidade e mortalidade são equivalentes, atingindo a capacidade de suporte K, caracterizando, assim, um equilíbrio estável (Scheffer, 2009).
No entanto, diferentes sistemas podem responder de maneira diferente às mudanças nas condições abióticas. Pode haver apenas um ponto de equilíbrio estável sob cada condição (fig. 1a e 1b). Ou então, sob uma mesma condição, pode haver mais de um equilíbrio estável (fig. 1c), caracterizando estados alternativos estáveis (Scheffer, 2009; Scheffer et al. 2001).
Fig. 1. Representação esquemática de maneiras nas quais o estado de equilíbrio de um sistema pode mudar de acordo com as condições abióticas. Em (a) e (b), há apenas um equilíbrio relativo à cada condição. Em ©, há dois pontos de equilíbrio estáveis possíveis para uma mesma condição (linhas contínuas) e um ponto de equilíbrio instável (linha tracejada). As setas representam a direção para qual o sistema vai quando não está em equilíbrio. (Scheffer, 2009)
Foi proposto pela primeira vez em 1960 que sistemas ecológicos podem se encontrar em um dentre vários estados alternativos estáveis (Beisner et al., 2003). Dentre os mecanismos que podem levar a esse certo estado alternativo estável observado estão as alças de feedback positivo (Scheffer, 2009; Scheffer & Carpenter, 2003). Um exemplo clássico de alça de feedback positivo ocorre em lagos rasos que apresentam dois estados alternativos estáveis: com água túrbida e predomínio de fitoplâncton na coluna d’água, ou com água límpida e predomínio de macrófitas fixadas no fundo do lago. No estado de águas límpidas, a presença de algas macrófitas mantém a água com baixa turbidez, permitindo a entrada de luz que mantém as macrófitas no sistema, fazendo que o sistema seja autossustentável (Blindow et al., 1993; Scheffer et al., 1993). Uma das maneiras principais pela qual as alças de feedback positivo se manifestam é através da facilitação (Kefi et al., 2016; Scheffer, 2009), quando uma espécie ou grupo de espécies alteram o ambiente, levando à facilitação deste mesmo grupo (Wilson & Agnew, 1992). Por exemplo, gramíneas introduzidas no Havaí alteram condições abióticas, facilitando o estabelecimento de mais gramíneas introduzidas (Mack et al., 2001).
Em uma situação de restauração ecológica, o sistema degradado pode ser um estado alternativo estável ao sistema original ou restaurado. No entanto, muitas vezes não é possível restaurar o ambiente degradado apenas alterando as condições abióticas (Westoby et al., 1989) devido à atuação de outros mecanismos, entre eles os mecanismos de feedback presentes no ambiente degradado (fig. 2) (Kéfi et al., 2016; Suding et al., 2004). Outros fatores, como fragmentação e perda de conectividade da paisagem também podem dificultar o processo de restauração da área degradada devido à recolonização limitada por espécies nativas. Ainda que às vezes projetos de restauração que alteram apenas as condições abióticas sejam bem-sucedidos, projetos de restauração que levam em conta diversos fatores (como alteração de condições e mudanças no mecanismo de feedback) frequentemente têm mais sucesso do que projetos que levam em conta apenas um fator (Suding et al., 2004; Westoby et al., 1989).
Fig. 2. Em (a) e (b), alterações nas condições do sistema no estado original (histórico) são acompanhadas de alterações nos mecanismos de feedback. No processo de restauração de (a), o restabelecimento de condições ambientais semelhantes às do ambiente original não leva o sistema de volta ao seu estado original. No processo de restauração de (b), os mecanismos de feedback são alterados em conjunto ao restabelecimento das condições ambientais, levando o sistema de volta ao seu estado original, atingindo o objetivo da restauração. (Suding et al., 2004)
Os dados que usarei no meu projeto de mestrado são relativos a um projeto de restauração ecológica de floresta de restinga em Caraguatatuba, litoral norte de São Paulo. Antes do início da restauração, em 2012, a área era uma pastagem dominada por gramíneas invasoras, com alguns arbustos. Para a preparação da área para a restauração, foi feita a remoção das gramíneas e arbustos invasores, e a calagem, para reduzir a acidez do solo. Após isso, foi feito o plantio de mudas. Ou seja, além da reintrodução de espécies nativas à região, houve alteração na condição do solo de maneira a facilitar o estabelecimento das mudas, e as plantas invasoras foram removidas do local, interrompendo uma possível alça feedback positivo do ambiente degradado.
O plantio de mudas foi feito em dois tratamentos diferentes. Em um dos tratamentos, as mudas foram plantadas em grupos multiespecíficos, e, em outro, as mudas foram plantadas isoladamente. Ao longo de 11 anos, foram feitos censos de sobrevivência e crescimento dessas mudas. Recentemente realizei a coleta de dados em campo sobre atributos funcionais dessas espécies. No meu projeto, espero determinar como atributos funcionais afetam a interação entre essas plantas através do efeito de vizinhança nos grupos multiespecíficos.
Referências Bibiliográficas
Beisner, B., Haydon, D., & Cuddington, K. (2003). Alternative stable states in ecology. Frontiers in Ecology and the Environment, 1(7), 376–382.
Blindow I., Andersson, G., Hargeby, A., & Johansson, S. (1993). Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology, 30(1): 159-167.
Kéfi, S., Holmgren, M., & Scheffer, M. (2016). When can positive interactions cause alternative stable states in ecosystems?. Functional Ecology, 30(1), 88-97.
Mack, M. C., D’Antonio, C. M., & Ley, R. E. (2001). Alteration of Ecosystem Nitrogen Dynamics by Exotic Plants: A Case Study of C 4 Grasses in Hawaii. Ecological Applications, 11(5), 1323.
Scheffer, M. (2009). Alternative Stable States. In: Critical Transitions in Nature and Society, Chapter II, pp. 11-36, Princenton University Press.
Scheffer, M., & Carpenter, S. R. (2003). Catastrophic regime shifts in ecosystems: linking theory to observation. Trends in Ecology & Evolution, 18(12), 648–656.
Scheffer, M., Carpenter, S., Foley, J. A., Folke, C., & Walker, B. (2001). Catastrophic shifts in ecosystems. Nature, 413(6856), 591–596.
Scheffer, M., Hosper, S. H., Meijer, M. L., Moss, B., & Jeppesen, E. (1993). Alternative equilibria in shallow lakes. Trends in ecology & evolution, 8(8), 275-279.
Suding, K. N., Gross, K. L., & Houseman, G. R. (2004). Alternative states and positive feedbacks in restoration ecology. Trends in ecology & evolution, 19(1), 46-53.
Westoby, M., Walker, B., & Noy-Meir, I. (1989). Opportunistic Management for Rangelands Not at Equilibrium. Journal of Range Management, 42(4), 266.
Wilson, J. B., & Agnew, A. D. Q. (1992). Positive-feedback Switches in Plant Communities. Advances in Ecological Research Volume 23, 263–336.
Aprofundar o conhecimento sobre processos biogeográficos pode auxiliar na compreensão de modelos de nicho ecológico
Ana Clara Kohara Roman
A visão de processos históricos e biogeográficos ganhou força na ecologia com estudos que viam uma relação entre o aumento da diversidade local e o número de espécies na região (Ricklefs, 1987). Compreende eventos de larga escala, temporal e espacial, e como esses processos influenciam na dispersão e na especiação de espécies (Heads, 2015), pois parte do pressuposto que, já que há dispersão de indivíduos entre populações, as interações ecológicas operam sobre escalas maiores (Ricklefs, 2004). Leva em consideração alguns aspectos, como o nicho ancestral do clado, o ponto de início da distribuição da espécie em questão, limitações impostas por aspectos abióticos, evolução de nicho e tempo desde a origem do clado. Dessa forma, é uma abordagem que procura perguntar quem fez o que, onde e quando, para entender abundância de espécies e então compreender como todo um cenário se originou (Wiens; Donoghue, 2004). Ou seja, quais eventos (climáticos, geológicos ou evolutivos), em escalas espaciais que vão de regional a global, operaram em quais locais e em qual momento para levar a processos como dispersão e adaptação a novos habitats, resultando no que vemos hoje em escala local (Jenkins, Ricklefs 2011). Para isso, é uma abordagem que faz uso de dados como informações filogenéticas, paleontológicas e geológicas para inferir sobre tais processos, já que não possibilita experimentação (Ricklefs, 1987).
Por ser um olhar que possui certa dificuldade de ser experimentado, considerando os diversos processos que influenciam padrões de biodiversidade, foi por muito tempo deixado de lado por ser classificado como inválido. Muito dessa recusa aos processos históricos advém de linhas teóricas de determinismo ambiental (Heads, 2015) e diferentes teorias para explicar a diversidade de comunidades, como a de diferenciação de nicho. Dessa forma, inicialmente, interações ecológicas locais foram consideradas os principais - e suficientes - fatores explicativos da diversidade de comunidades (Ricklefs, 2004). Processos de mais longo prazo, como a especiação, já eram considerados sob outras óticas, como a teoria neutra - porém é considerada em taxa constante. Neste cenário, o entendimento de processos biogeográficos dá destaque à importância da especiação, aprofundando seu entendimento para explicar, portanto, como as espécies surgiram e evoluíram, de forma a avaliar a diversidade local, aproximando a ecologia da biogeografia.
Processos biogeográficos começaram a ser mais incorporados na ecologia a partir do momento em que se passou a enxergar a importância de uma visão histórica-global e a relevância de um olhar regional para análises locais (Ricklefs, 1987). Assim, esta visão compreende a importância do aporte regional para a diversidade de uma comunidade - dispersão como um link entre processos mais rápidos, como competição e predação, e mais lentos, como especiação e extinção (Harrison; Cornell, 2008). Além disso, é uma visão que contribuiu para o campo da ecologia. Uma dessas contribuições foi que, após o conceito começar a ser mais aceito, aumentou-se o uso de informações filogenéticas no campo da pesquisa ecológica (Jenkins; Ricklefs, 2011), possibilitando diferentes olhares. Além disso, é uma perspectiva que ajuda a entender situações-problema como o gradiente latitudinal de diversidade (Mittelbach, 2007) e que auxilia na comparação de padrões comunitários entre diferentes regiões (Vellend, 2010). Sob essa ótica de processos históricos e biogeográficos, alguns conceitos foram desenvolvidos e seguem contribuindo para a pesquisa em ecologia de comunidades, como o de conservadorismo de nicho.
Meu projeto objetiva construir um modelo de nicho ecológico para estimar a distribuição de vetores de febre amarela (mosquitos principalmente dos gêneros Haemagogus e Sabethes) na Amazônia legal em 2050. Modelagem de nicho ecológico é uma metodologia que estima a distribuição de uma espécie no espaço através de dados existentes de pontos de ocorrência dessa espécie e parâmetros ambientais desses locais (Peterson, 2006). O conceito de conservadorismo de nicho, inclusive, é uma interface de contato entre os modelos de nicho ecológico e a abordagem de processos biogeográficos - para os modelos, parte-se do pressuposto que os nichos das espécies são conservados por tempo o suficiente para que a correlação entre os pontos de ocorrência dos indivíduos de uma espécie e as variáveis ambientais operando nestes locais se mantenha relativamente constante durante muitos anos, possibilitando extrapolações dessas correlações para o futuro (Peterson, 2007). Embora tenham um grande potencial, os modelos de nicho possuem algumas limitações. Uma das principais é que uma boa projeção de distribuição deveria ser baseada no nicho fundamental das espécies (conjunto de fatores abióticos responsáveis pela persistência a longo prazo de uma população num determinado local com taxa de crescimento intrínseca acima de zero), mas só temos acesso a ocorrência de indivíduos em seu nicho existente (apenas uma porção do nicho fundamental, que são os locais que as espécies de fato ocupam). Este problema dialoga também com a problemática de um excessivo determinismo ambiental. Para tentar superar parcialmente esta limitação, uma das práticas frequentemente aplicadas é a de analisar criticamente os pontos de ocorrência que se há em mãos, de forma a excluir aqueles pontos que estão em locais que a espécie provavelmente estava de forma passageira, não definitiva. Porém, acredito que há mais camadas a serem exploradas.
Uma das primeiras questões que me veio à cabeça na disciplina foi com o artigo de Cottenie (2005), que aponta que a variabilidade de estruturas comunitárias pode ser menos de 30% atribuída a variáveis ambientais. De forma análoga, ao longo da disciplina, fui aprendendo que não basta uma espécie chegar a um local para se estabelecer lá: ela é submetida a interações ecológicas (como competição), a seleção, à entrada e saída de outras espécies, etc, até que sua população entre em equilíbrio na comunidade. Porém, também fui entendendo que a importância de cada processo depende da escala que se olha, e que estrutura, composição, e abundância são parâmetros diferentes de presença. Como meu objetivo é avaliar possíveis presenças e a uma amplitude espacial superior à de uma comunidade, entendi que não é tão ruim fazer uso de modelos baseados em variáveis ambientais. Assim, é necessário compreender que um modelo de distribuição de uma espécie cujos parâmetros são variáveis ambientais será, naturalmente, “ambientalmente determinístico”, mas que práticas de bom uso dos dados de input e de análise do output podem ajudar a superar essa limitação. Neste contexto, a visão de processos históricos e biogeográficos, que também olha para uma escala maior, pode contribuir. Wiens e Donoghue (2004) oferecem um ponto de vista de mão dupla: variáveis climáticas, por si só, não levam à presença ou mudança na abundância de uma espécie num local, mas estimulam processos de dispersão, especiação e extinção que, por sua vez, também vão moldando ao longo do tempo os locais em que a espécie se apresenta. Esta visão me ajudou muito a entender o que os modelos de nicho ecológico querem dizer.
Tendo isso em vista, vejo algumas contribuições que um olhar mais cauteloso sobre processos históricos pode auxiliar no meu projeto.
- Interpretação de pontos de ocorrência: é possível filtrar os pontos de ocorrência realmente confiáveis entendendo como se deu o surgimento dos Haemagogus e Sabethes ao longo do tempo. Estudos históricos sobre estes gêneros, como o de Pedro et al. (2008) são ferramentas importantes.
- Conservadorismo de nicho: aprofundar pesquisas se realmente este fenômeno ocorre nas espécies dos gêneros estudados. Apesar de este pressuposto ser generalizado nos modelos de nicho ecológico, Peterson (2007) aponta que ainda não se sabe o quanto isto pode se aplicar para invertebrados. Até então não havia tido ideias sobre como avaliar isto, mas acredito que agora possuo algumas ferramentas.
- Interpretação de projeções: as projeções dos modelos, consensualmente, são filtradas a partir do conhecimento de que há locais que as espécies não conseguem atingir devido a barreiras físicas. Mas, além disso, conhecer como esses mosquitos se comportam em processos de deriva e como responderam a mudanças de ambiente antigamente pode auxiliar na interpretação da validade das minhas projeções.
Portanto, a disciplina como um todo me trouxe novos olhares, mas o de processos históricos e biogeográficos fornece algumas contribuições objetivas que certamente enriquecerão meu trabalho.
Referências bibliográficas
COTTENIE, K. Integrating environmental and spatial processes in ecological community dynamics. Ecology Letters, v. 8, n. 11, p. 1175–1182, 2005.
ELITH, J.; LEATHWICK, J. R. Species distribution models: Ecological explanation and prediction across space and time. Annual Review of Ecology, Evolution, and Systematics, v. 40, p. 677–697, 2009.
HARRISON, S.; CORNELL, H. Toward a better understanding of the regional causes of local community richness. Ecology Letters, v. 11, n. 9, p. 969–979, 2008.
HEADS, M. The relationship between biogeography and ecology: Envelopes, models, predictions. Biological Journal of the Linnean Society, v. 115, n. 2, p. 456–468, 2015.
JENKINS, D. G.; RICKLEFS, R. E. Biogeography and ecology: Two views of one world. Philosophical Transactions of the Royal Society B: Biological Sciences, v. 366, n. 1576, p. 2331–2335, 2011.
MITTELBACH, G. G. et al. Evolution and the latitudinal diversity gradient: speciation, extinction and biogeography. Ecology Letters, v. 10, 2007.
PEDRO, P. M.; SALLUM, M. A.; BUTLIN, R. K. Forest-obligate Sabethes mosquitoes suggest palaeoecological perturbations. Heredity, v. 101, n. 2, p. 186–195, 2008.
PETERSON, A. T. Ecologic niche modeling and spatial patterns of disease transmission. Emerging Infectious Diseases, v. 12, n. 12, p. 1822–1826, 2006.
PETERSON, A. T. Ecological niche modelling and understanding the geography of disease transmission. Veterinaria italiana, v. 43, n. 3, p. 393–400, 2007.
RICKLEFS, R. E. Community Diversity: Relative Roles of Local and Regional Processes. Science, 1987.
RICKLEFS, R. E. A comprehensive framework for global patterns in biodiversity. Ecology Letters, v. 7, n. 1, p. 1–15, 2004.
VELLEND, M. CONCEPTUAL SYNTHESIS IN COMMUNITY ECOLOGY. The Quarterly Review of Biology, v. 85, n. 2, p. 183–206, 2010.
WIENS, J. J.; DONOGHUE, M. J. Historical biogeography, ecology and species richness. Trends in Ecology and Evolution, v. 19, n. 12, p. 639–644, 2004.
Considerações sobre os efeitos da Partição de Nicho sobre a decomposição em riachos urbanos
João Pedro Calil Barcellos Leite
O modo como se dá o funcionamento de ecossistemas é uma das questões que intrigam os ecólogos há décadas. A ideia de que a biodiversidade influencia a dinâmica ecossistêmica remonta ao fim da década de 50, quando Elton propôs que os sistemas mais diversos apresentam, entre outras propriedades, maior estabilidade (Tilman et al 2014). Uma teoria ecológica que sustenta tal proposição é a Teoria de Nicho, mais especificamente o conceito de Partição de Nicho. Este, é um mecanismo que diz respeito às capacidades diferentes das espécies de explorar recursos distintos, de modo que cada espécie monopoliza, ou utiliza com maior eficiência, uma parcela dos recursos disponíveis (Chesson 2000, Finke & Snyder 2008). Assim, se em uma comunidade houver competição intraespecífica mais intensa do que contra outras espécies - devido a maior semelhança de nicho entre indivíduos de uma mesma espécie - é possível que o aproveitamento total dos recursos nessa comunidade seja maior quando há maior diversidade (MacArthur 1970, Chesson 2000). Portanto, a Teoria de Nicho clássica hipotetiza que através da Partição de Nicho a diversidade deve ser capaz de alterar funções ecossistêmicas como produtividade primária, conversão de biomassa e ciclagem de nutrientes (MacArthur 1970, Chase & Liebold 2003).
Contudo, a relevância do mecanismo de Partição de Nicho para os efeitos da diversidade sobre o funcionamento ecossistêmico não se deu tão rapidamente. Na década de 70, as ideias de Elton foram deixadas de lado devido à grande ênfase matemática dentro da Ecologia na época. Modelos teóricos descritos por May, em 73, supostamente contrariavam as previsões de Elton, e sugeriam que a estabilidade de uma população diminui conforme interage com mais espécies. Apesar de no ano seguinte, May ter proposto uma explicação alternativa para a questão - propriedades ecossistêmicas poderiam ser mais estáveis em alta diversidade, mesmo com menor estabilidade no nível populacional - o resultado permaneceu o mesmo, por causa do crédito que então foi dado ao modelo matemático anteriormente proposto (Tilman et al 2014).
A Partição de Nicho ressurgiu como um processo pelo qual diversidade influenciaria funções ecossistêmicas a partir do modelo de competição de Tilman. Ele experimentou a possibilidade de coexistência de duas espécies de algas no lago Michigan, ao longo de um gradiente de dois nutrientes que limitam o crescimento destas algas. Quando as espécies foram limitadas por apenas um dos nutrientes, aquela que apresentava população viável sob a menor disponibilidade daquele nutriente (R*) eliminava a outra competidora. Entretanto, quando foram limitadas pelos dois nutrientes, as duas espécies coexistiram, porque cada uma apresentava um R* menor para somente um dos nutrientes (Tilman 1977, Tilman 1981). Teoricamente, esta coexistência possibilitaria também maior exploração de recursos, uma vez que cada recurso estaria sendo explorado pela espécie mais eficiente em alocar o devido recurso. Isto motivou Tilman a uma série de experimentos na década de 90, utilizando gramíneas em canteiros com diferentes níveis de diversidade, ele buscou evidências empíricas do padrão de influência da diversidade sobre funções ecossistêmicas. Juntamente com experimentos de outros autores na mesma época, mostraram um padrão entre maior diversidade de espécies com maior produtividade primária e estabilidade (Tilman 1996, Naeem et al 1995, Tilman et al 2014).
Seguindo a linha de Tilman, toda uma geração de ecólogos se voltou a testar os efeitos da biodiversidade sobre o funcionamento ecossistêmico. A preocupação em compreender os desdobramentos das ações humanas para o meio ambiente também motivou esse esforço, em razão da alarmante taxa de extinção de espécies percebida durante a década de 80 (Cardinale et al 2012, Tilman et al 2014). De modo que, após mais de 20 anos de pesquisa, alguns consensos mais robustos foram eleitos. Tais como: A perda de espécies diminui a eficiência das comunidades biológicas em assimilar recursos essenciais, converter nutrientes em biomassa, reciclar e decompor matéria orgânica; Funções ecossistêmicas são mais estáveis sob níveis elevados de biodiversidade, principalmente quanto à estabilidade ao longo do tempo; O impacto da perda de biodiversidade sobre as funções ecossistêmicas não é linear, e sua magnitude pode variar a depender da identidade e do número de espécies envolvidas; E por fim, que os efeitos da diversidade sobre a produtividade se devem tanto à presença de espécies chave, muito produtivas, como também a uma complementaridade de atributos funcionais das espécies (Cardinale et al 2006, Cardinale et al 2012). Entretanto, não foi bem elucidado até que medida o mecanismo de Partição de Nicho é responsável por estes padrões (Loreau & Hector 2001, Cardinale et al 2006, Finke & Snyder 2008, Cardinale et al 2011, Cardinale et al 2012).
Por conta disso é fundamental que, ao se debruçar sobre uma função ecossistêmica com o intuito de compreender o efeito da biodiversidade sobre ela, haja um empenho em compreender qual o mecanismo por trás do padrão observado. Um exemplo de função ecossistêmica a ser estudada é a decomposição de matéria orgânica em riachos urbanos. Devido à cada vez maior literatura sinalizando que há uma relação antagônica entre a biodiversidade e a intensidade da urbanização, esperamos que haja também um antagonismo entre urbanização e a decomposição nos riachos. Porém, como diferentes processos ecológicos podem gerar padrões semelhantes, distinguir entre eles é o grande desafio da Ecologia de Comunidades (Vellend 2010). Assim, é relevante que compreendamos quais outros mecanismos poderiam estar em atuação e como se diferenciam da Partição de Nicho. Enquanto o nosso mecanismo em questão, prevê que a comunidade de microrganismos, bactérias e hifomicetos, terá maior eficiência na decomposição quando apresentar maior diversidade de atributos funcionais e microrganismos especialistas em certos tipos de substratos, outros processos apresentam previsões alternativas. Um processo baseado em estocasticidade e seleção, chamado “efeito de seleção”, supõe que em comunidades mais diversas a probabilidade de uma espécie muito produtiva estar presente é maior (Aarssen 1997), logo as diferenças na decomposição seriam devido a poucas espécies superprodutivas. Outro mecanismo ainda, poderia ser o efeito de um estresse abiótico que influencia o desempenho das espécies de decompositores (Pascoal et al 2010), e que co-varia com a perda de espécies promovida pela urbanização, ou seja seria um efeito aparente da diversidade (Huston 1997).
De todo modo, a importância histórica da Partição de Nicho para o desenvolvimento da compreensão dos efeitos da diversidade para o ecossistema é notável. Contudo, as evidências de que este é um mecanismo importante para os efeitos da biodiversidade sobre o funcionamento ecossistêmico ainda estão se somando (Venail et al 2008, Finke & Snyder 2008). Assim, é interessante assinalar o papel da experimentação, para aumentar o poder de inferência sobre a causalidade entre os processos e os padrões observados, de tal forma que amostragens de larga escala que buscam efeitos, por exemplo, da urbanização sobre a decomposição, se beneficiaram muito de abordagens experimentais integradas (Werner 1998). Para talvez, constatar a relevância mais que histórica da Partição de Nicho no funcionamento dos ecossistemas.
Referências Bibliográficas
Aarssen, Lonnie W. “High productivity in grassland ecosystems: effected by species diversity or productive species?.” Oikos 80 (1997): 183-184.
Cardinale, Bradley J., et al. “Effects of biodiversity on the functioning of trophic groups and ecosystems.” Nature 443.7114 (2006): 989-992.
Cardinale, Bradley J., et al. “The functional role of producer diversity in ecosystems.” American journal of botany 98.3 (2011): 572-592.
Cardinale, Bradley J., et al. “Biodiversity loss and its impact on humanity.” Nature 486.7401 (2012): 59-67.
Chase, Jonathan M., and Mathew A. Leibold. Ecological niches: linking classical and contemporary approaches. University of Chicago Press, 2009.
Chesson, Peter. “Mechanisms of maintenance of species diversity.” Annual review of Ecology and Systematics 31.1 (2000): 343-366.
Elton Charles S. 1958. The Ecology of Invasions by Animals and Plants. London: Methuen
Finke, Deborah L., and William E. Snyder. “Niche partitioning increases resource exploitation by diverse communities.” Science 321.5895 (2008): 1488-1490.
Huston, Michael A. “Hidden treatments in ecological experiments: re-evaluating the ecosystem function of biodiversity.” Oecologia 110 (1997): 449-460.
Loreau, Michel, and Andy Hector. “Partitioning selection and complementarity in biodiversity experiments.” Nature 412.6842 (2001): 72-76.
MacArthur, Robert. “Species packing and competitive equilibrium for many species.” Theoretical population biology 1.1 (1970): 1-11.
May, Robert M. 1973. Stability and Complexity in Model Ecosystems. Monogr. Popul. Biol. 6. Princeton, NJ: Princeton Univ. Press. 1st ed.
May, Robert M. 1974. Stability and Complexity in Model Ecosystems. Monogr. Popul. Biol. 6. Princeton, NJ: Princeton Univ. Press. 1st ed., 2nd printing
McKinney, Michael L. “Urbanization, Biodiversity, and ConservationThe impacts of urbanization on native species are poorly studied, but educating a highly urbanized human population about these impacts can greatly improve species conservation in all ecosystems.” Bioscience 52.10 (2002): 883-890.
McKinney, Michael L. “Effects of urbanization on species richness: a review of plants and animals.” Urban ecosystems 11 (2008): 161-176.
Naeem, Shahid, et al. “Empirical evidence that declining species diversity may alter the performance of terrestrial ecosystems.” Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences 347.1321 (1995): 249-262.
Pascoal, Cláudia, et al. “Realized fungal diversity increases functional stability of leaf litter decomposition under zinc stress.” Microbial ecology 59 (2010): 84-93.
Tilman, David. “Resource competition between plankton algae: an experimental and theoretical approach.” Ecology 58.2 (1977): 338-348.
Tilman, David. “Tests of resource competition theory using four species of Lake Michigan algae.” Ecology 62.3 (1981): 802-815.
Tilman, David. “Biodiversity: population versus ecosystem stability.” Ecology 77.2 (1996): 350-363.
Tilman, David, Forest Isbell, and Jane M. Cowles. “Biodiversity and ecosystem functioning.” Annual review of ecology, evolution, and systematics 45 (2014): 471-493.
Vellend, Mark. “Conceptual synthesis in community ecology.” The Quarterly review of biology 85.2 (2010): 183-206.
Venail, Patrick A., et al. “Diversity and productivity peak at intermediate dispersal rate in evolving metacommunities.” Nature 452.7184 (2008): 210-214.
Werner, Earl E. “Ecological experiments and a research program in community ecology.” Experimental ecology: issues and perspectives (1998): 3-26.
Modelos analíticos espacialmente explícitos de dispersão em ecologia de comunidades
Mikael Marcondes
A dispersão é definida como o movimento dos organismos através do espaço, um dos quatro processos fundamentais responsáveis pela estruturação da diversidade em comunidades: seleção, deriva, dispersão e especiação (Vellend, 2010). Modelos em ecologia de comunidades que incorporam a dispersão como processo fundamental central dividem-se em dois grandes grupos, espacialmente explícitos (SEM), que explicitamente levam em conta as posições dos organismos ao modelar como se dá a interação entre organismos e ambiente, e implícitos (SIM) (DeAngelis & Yurek, 2017). SEM’s podem ser tanto analíticos, i.e. exibir “soluções fechadas/analíticas”, relações matemáticas funcionalmente bem-definidas entre variáveis dependentes e independentes [e.g. equações de reação-difusão (RDE), equações de íntegro-diferença (IDE) etc.], quanto computacionais (e.g. IBMs, autômatos celulares etc.); o foco deste ensaio será nos SEM’s analíticos, tanto por sua tratabilidade, quanto por uma postura filosófica com respeito à utilidade de modelos versus simulações ao se investigar questões mais gerais a respeito da natureza (Levins, 1966; Maynard-Smith, 1975; Levin, 1992). Os trabalhos seminais em genética de populações (Kolmogorov et al., 1937; Fisher, 1937), seguidos por análises mais aplicadas ao contexto de ecologia de populações (Skellam, 1951; Kierstead & Slobodkin, 1953), praticamente inauguram o uso de SEM’s analíticos de dispersão, bem como a incorporação dos modelos de RDE’s ao ferramental matemático dos ecólogos teóricos; o acúmulo de longa data de esforços de modelagem e tentativas de descrição e incorporação de detalhes das mais distintas comunidades ecológicas produziu alguns livros-texto sobre o tópico (Okubo, 2001; Cantrell & Cosner, 2003). Modelos de RDE’s permitem ainda a combinação de “termos de difusão” com “termos do tipo Lotka-Volterra” (Pacala & Roughgarden, 1982) para descrever a interação entre espécies (usualmente predação ou competição, tipos de seleção na síntese conceitual de Vellend), mas também “termos do tipo ‘respostas funcionais de Holling’” (Holling, 1959), que levam em consideração características tais quais o “tempo de manuseio/saciedade” na busca por, tratamento da e/ou digestão da presa por parte do predador (Rosenzweig & MacArthur, 1963). Outra abordagem de um SEM analítico mais recentemente estudada no contexto de ciclos de vida anuais/periódicos (como os de algumas plantas e insetos) é a de IDE’s (Kot & Schaffer, 1986; Lutscher, 2019), em que as espécies têm uma etapa de reprodução (descrita por uma função de crescimento populacional) muito rápida se comparada com a etapa de dispersão (descrita por um kernel de dispersão). No limite de tempo contínuo, modelos de IDE’s tornam-se modelos de RDE’s (Lutscher, 2019).
O argumento principal a ser adotado aqui em favor do uso de SEM’s em ecologia de comunidades é essencialmente o mesmo de Cantrell & Cosner (2001): evidentemente, o espaço afeta a dinâmica das populações interagentes em uma comunidade, pois espécies competidoras que não coexistiriam em uma área bem-delimitada, podem coexistir na mesma área se esta apresentar subdivisões e houver diferenças nas taxas de dispersão de cada espécie (Huffaker, 1958); por outro lado, modelos de espaço discreto (como os de metacomunidades, um tipo de SIM) não dão conta, muitas vezes, de prever como as diferenças de densidade populacional através do espaço surgem em decorrência da interação da dispersão com outros processos fundamentais (e.g. competição/seleção). Para além disso, alguns fenômenos de interesse da ecologia de comunidades, como a invasão ecológica, são intrínseca e explicitamente dependentes do espaço, como é o caso do rato almiscarado na Áustria, cuja área de ocupação aumentou a partir de sua introdução de acordo com uma frente de onda tipicamente compatível com as soluções de um modelo de RDE (Skellam, 1951) [outros exemplos incluem a píton birmanesa (Bonneau et al., 2016) e o teiú-gigante (Bonneau, 2017), para listar alguns]. Alguns fenômenos da ecologia de comunidades, como a “libertação de competição” (Azevedo et al., 2012), sequer podem ser reproduzidos por SIM’s, pois é o papel do espaço como mediador explícito das interações entre espécies que faz com que esta propriedade emergente surja.
Uma classe secundária de argumentos a respeito do porquê SEM’s são os modelos mais apropriados para descrever a dispersão de indivíduos de uma população é justamente a natureza das soluções exibidas por modelos de RDE’s em duas dimensões espaciais, os chamados “padrões de Turing” (Turing, 1952): espécies encontram-se, muitas vezes em distribuições espaciais aparentemente descontínuas, o que historicamente motivou o surgimento de modelos de metacomunidades/SIM’s, quando na verdade, seria igualmente provável que os dados observacionais apenas estivessem retratando a baixíssima probabilidade de se encontrar indivíduos de uma dada população fora de suas unidades de reprodução, propriedade emergente de SEM’s como modelos de RDE’s na forma de padrões de Turing. Obviamente, modelos de RDE’s são mais complexos que modelos de metacomunidades, e modelos mais simples são usualmente preferíveis; no entanto, modelos de RDE’s exibem os comportamentos prévios (e.g. frentes de ondas de difusão) que são impossíveis de serem reproduzidos por SIM’s, fazendo com que SEM’s sejam de fato os modelos mais simples a reproduzir ambos padrões.
Fig. 1: “Padrões de Turing” presentes nas soluções de modelos de RDE’s em duas dimensões espaciais são uma das possíveis explicações do porquê populações de uma dada espécie se distribuem de maneira aparentemente discreta ao longo do espaço contínuo. Fonte: Wikimedia Commons.
Em genética de populações, tipicamente adotou-se (e ainda adota-se) modelos muito simplificados de seleção, como o de paisagem adaptativa (Wright, 1932) e de fluxo gênico/dispersão, como o de stepping stones (Kimura & Weiss, 1964), em contraposição aos modelos mais elaborados de seleção, com termos do tipo Lotka-Volterra (cujos coeficientes de competição podem ser feitos funções do tempo e do espaço) e de dispersão, com termos de reação-difusão, comuns em ecologia de comunidades. Dessa forma, é de esperar-se que, assim como a genética de populações proveu à ecologia de comunidades por muito tempo com ferramental teórico/matemático, antevendo em cerca de vinte anos os usos de RDE’s (Kolmogorov et al., 1937; Fisher, 1937) e da teoria neutra (Kimura, 1968), que agora a genética de populações possa incorporar os avanços da ecologia de comunidades em implementar modelos mais complexos, como os chamados “eco-evolutivos” (Norberg et al., 2012).
No contexto de genética de populações humanas, é possível esperar ainda o aporte de SEM's (como modelos de RDE's) no estudo da evolução humana, uma vez que modelos de gargalos populacionais em série ainda não dão conta de explicar grande parte da variação e distância genética entre subpopulações do globo (Ramachandran, 2005), ao passo em que modelos de RDE's com condições de contorno impostas pela geografia terrestre e com termos de Lotka-Volterra que representassem a interação com populações por muito tempo isoladas (como a de neandertais) talvez dessem conta de explicar estes padrões.
Referências Bibliográficas
Vellend, M. (2010). Conceptual Synthesis in Community Ecology. The Quarterly Review of Biology, 85(2), 183–206. https://doi:10.1086/652373
DeAngelis, D.L., Yurek, S. (2017). Spatially Explicit Modeling in Ecology: A Review. Ecosystems, 20, 284–300. https://doi.org/10.1007/s10021-016-0066-z
Levins, R. (1966). The Strategy of Model Building in Population Biology. American Scientist, 54(4), 421–431. http://www.jstor.org/stable/27836590
Maynard-Smith, J. (1975). Models in Ecology. Cambridge University Press.
Levin, S.A. (1992). The Problem of Pattern and Scale in Ecology: The Robert H. MacArthur Award Lecture. Ecology, 73: 1943-1967. https://doi.org/10.2307/1941447
Kolmogorov, A., Petrovskii, I. G., Piskunov, N. S. (1937). Исследование уравнения диффузии, соединенной с возрастанием количества вещества, и его применение к одной биологической проблеме (“Um estudo da equação de difusão com aumento na quantidade de uma substância e sua aplicação a um problema biológico”). Moscow University Mathematics Bulletin. Mech. 1, 1–25.
Fisher, R.A. (1937). The wave of advance of advantageous genes. Annals of Eugenics, 7: 355-369. https://doi.org/10.1111/j.1469-1809.1937.tb02153.x
Skellam, J. G. (1951). Random Dispersal in Theoretical Populations. Biometrika, Volume 38, Issue 1-2, 196–218. https://doi.org/10.1093/biomet/38.1-2.196
Kierstead, H., Slobodkin, L.B. (1953). The Size of Water Masses containing Plankton Bloom. Journal of Marine Research, 12, 141-147.
Okubo, A., Levin, S. A. (2001). Diffusion and Ecological Problems: Modern Perspectives. Springer-Verlag.
Cantrell, R. S., Cosner, C. (2003). Spatial ecology via reaction-diffusion equations. Wiley.
Pacala, S. W., & Roughgarden, J. (1982). Spatial heterogeneity and interspecific competition. Theoretical Population Biology, 21(1), 92–113. https://doi:10.1016/0040-5809(82)90008-9
Holling, C. S. (1959). Some Characteristics of Simple Types of Predation and Parasitism. The Canadian Entomologist, 91(07), 385–398. https://doi:10.4039/ent91385-7
Rosenzweig, M. L., & MacArthur, R. H. (1963). Graphical Representation and Stability Conditions of Predator-Prey Interactions. The American Naturalist, 97(895), 209–223. https://doi.org/10.1086/282272
Kot, M., & Schaffer, W. M. (1986). Discrete-time growth-dispersal models. Mathematical Biosciences, 80(1), 109–136. https://doi.org/10.1016/0025-5564(86)90069-6
Lutscher, F. (2019). Integrodifference equations in spatial ecology. Springer.
Huffaker, C. B. (1958). Experimental Studies on Predation: Dispersion Factors and Predator-Prey Oscillations. Hilgardia, 27, 343–383. https://doi.org/10.3733/hilg.v27n14p343
Bonneau, M., Johnson, F. A., & Romagosa, C. M. (2016). Spatially explicit control of invasive species using a reaction–diffusion model. Ecological Modelling, 337, 15–24. https://doi.org/10.1016/j.ecolmodel.2016.05.013
Bonneau, M., Johnson, F. A., Smith, B. J., Romagosa, C. M., Martin, J., &; Mazzotti, F. J. (2017). Optimal control of an invasive species using a reaction‐diffusion model and Linear Programming. Ecosphere, 8(10). https://doi.org/10.1002/ecs2.1979
Azevedo, F., Kraenkel, R. A., & Pamplona da Silva, D. J. (2012). Competitive release and area effects. Ecological Complexity, 11, 154–159. https://doi.org/10.1016/j.ecocom.2012.06.001
Turing, A. M. (1952). The chemical basis of morphogenesis. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. The Royal Society. 237 (641): 37–72. https://doi:10.1098/rstb.1952.0012
Wright, S. (1932). The roles of mutation, inbreeding, crossbreeding and selection in evolution. Proceedings of the Sixth International Congress on Genetics 1, 356–366.
Kimura, M., Weiss, G. H. (1964). The stepping stone model of population structure and the decrease of genetic correlation with distance. Genetics, 49(4), 561–576. https://doi.org/10.1093/genetics/49.4.561
Kimura, M. (1968). Evolutionary rate at the molecular level. Nature. 217 (5129): 624–626. https://doi.org/10.1038/217624a0
Norberg, J., Urban, M. C., Vellend, M., Klausmeier, C. A., Loeuille, N. (2012). Eco-evolutionary responses of biodiversity to climate change. Nature Climate Change, 2(10), 747–751. https://doi.org/10.1038/nclimate1588
Ramachandran, S., Deshpande, O., Roseman, C. C., Rosenberg, N. A., Feldman, M. W.; Cavalli-Sforza, L. L. (2005). Support from the relationship of genetic and geographic distance in human populations for a serial founder effect originating in Africa. Proceedings of the National Academy of Sciences, 102(44), 15942–15947. https://doi.org/10.1073/pnas.0507611102
A evolução da saturação, de comunidades à ecossistemas
Samuel Augusto Aguiar dos Anjos
Saturação é o termo que se refere ao estado de uma comunidade que atingiu seu número máximo de capacidade de suporte, ou seja, é a ideia de que comunidades possuem um limite no qual a entrada de novas espécies só pode ocorrer por exclusão de uma já existente. A capacidade de suporte de cada comunidade é definida pelas condições ambientais de cada comunidade, essa ideia vem diretamente da teoria de biogeografia de ilhas (MacArthur e Wilson, 1987). Uma comunidade estar saturada ou não, implica em diversas questões e possíveis interações ecológicas distintas, por exemplo, uma comunidade saturada é considerada em equilíbrio, a taxa de especiação e de imigração é igual a taxa de extinção e a comunidade é fechada para novas espécies, o que define quais espécies estão presentes é a dinâmica de interações intraespecíficas. Já uma comunidade não saturada, é compreendida como dinâmica no espaço e no tempo, sendo que a taxa de especiação e imigração podem ser maiores que a de extinção e o número máximo de espécies é definido apenas pelo pool regional de espécies [1].
A ideia de saturação se desenvolveu inicialmente dentro da ecologia de comunidades, sendo utilizada para desenvolver questões sobre como os limites físicos do ambiente limitam a biodiversidade. Como a ideia de uma comunidade saturada gira em torno da premissa de que, em ambientes saturados, o que molda a diversidade são relações intraespecíficas, como predação e competição, experimentos de compensação de densidade em ilhas e de remoção (eg. [2,3]) fortaleceram a ideia, pois mostravam a força e a importância dessas relações bióticas moldando a diversidade. Porém o que poderia mesmo demonstrar a pressão exercida por um ambiente saturado, são experimentos de adição de espécies, que são logisticamente difíceis [4]. Experimentos de semeio nas savanas norte americanas [5,6] mostraram que mesmo em um ambiente teoricamente saturado, mais espécies podem ser adicionadas em pequenas áreas, o que indica que o que impede a entrada de novas espécies, são apenas limites na dispersão, o que vai contra a ideia inicial de MacArthur e Wilson, que assumiram que a dispersão não era um fator limitante. Outros experimentos levaram à mesma conclusão, desde experimentos de colonização [7,8], análises de múltiplos habitats [9,10,11] e invasões de espécies exóticas que não levaram à exclusão de espécies nativas [12-16]. Com isso, ecologos passaram a aceitar que os habitats não estão saturados, mas que o que define uma coleção local de espécies é a capacidade de dispersão da coleção regional, e não necessariamente a saturação do local.
A teoria de biogeografia de ilhas e a ideia de saturação de habitats inspirou a análise paleontológica de dinâmicas de diversidade em tempo profundo [17-19], porém, existem questões que dificultam o uso da ideia desenvolvida por MacArthur e Wilson no âmbito da paleontologia, por exemplo, existem muitas questões diferentes envolvidas na colonização de ilhas e na evolução da biota terrestre, o que dificulta o uso de modelos logísticos em tempo profundo, além disso, a definição de pool de espécies pode ser diferente se analisada nos âmbitos da paleontologia, da filogenia e da ecologia, o que leva a formas diferentes de ver como a biodiversidade se encaixaria em um modelo de crescimento logístico [20].
De uma forma geral, na macroevolução, a ideia de saturação ainda existe como um debate, se a biota pode realmente atingir um equilíbrio de diversidade ou se esse equilíbrio simplesmente não existe em uma análise de tempo profundo.
Em minha pesquisa vou estudar sobre a ideia de que as taxas médias de especiação e extinção dentro do mesmo clado são iguais, essa ideia sugere que existe um equilíbrio dinâmico ao longo da vida de um grupo, ou seja, quando a fase de diversificação de um grupo atinge seu limite, ou se satura, a única forma de novas espécies surgirem é pela extinção de outra já existente.
Uma forma de olhar para essa questão, é o ponto de vista da teoria de biogeografia de ilhas, ou seja, se a saturação é realmente uma possibilidade, então faz sentido que em dado momento as taxas se igualem e, em média, para que uma nova espécie surja, outra seja extinta. Outra forma de olhar esse problema é a de que por se tratar de um assunto que ocorre em um nível temporal muito distinto das relações observadas em ilhas e comunidades, é difícil traçar uma linha direta entre a ideia de saturação e a da igualdade das taxas de especiação e extinção, principalmente tendo em vista que a área da macroevolução não entrou em concordância sobre a viabilidade da noção de equilíbrio em tempo profundo.
Levando em consideração que o estudo da biologia, e principalmente a ecologia, se concentra em objetos de estudo que estão em constante mudança e que são influenciados por diversas variáveis, é difícil imaginar que teremos certeza um dia se comunidades, ou mesmo a biota terrestre, podem ficar saturadas ou não, o que podemos pelo menos esperar é que nossos esforços e estudos futuros nos tragam uma ideia mais elaborada e clara sobre como a diversidade do nosso planeta evoluiu e foi moldada pelos diversos fatores bióticos e abióticos que permeiam toda vida na Terra.
Referências bibliográficas
1. Mateo, R. G., Mokany, K., & Guisan, A. (2017). Biodiversity models: what if unsaturation is the rule?. Trends in Ecology & Evolution, 32(8), 556-566.
2. Schoener, T.W. 1983 Field experiments on interspecific competition. Am. Nat. 122, 240–285. (doi:10.1086/284133)
3. Díaz, S., Symstad, A. J., Chapin, F. S., Wardle, D. A. & Huenneke, L. F. 2003 Functional diversity revealed by removal experiments. Trends Ecol. Evol. 18, 140–146. (doi:10.1016/S0169-5347(03)00007-7)
4. Ricklefs, R. E., & Jenkins, D. G. (2011). Biogeography and ecology: towards the integration of two disciplines. Philosophical Transactions of the Royal Society B: Biological Sciences, 366(1576), 2438-2448.
5. Houseman, G. R. & Gross, K. L. 2011 Linking grassland plant diversity to species pools, sorting and plant traits. J. Ecol. 99, 464–472.
6. Tilman, D. 1997 Community invasibility, recruitment limitation, and grassland biodiversity. Ecology 78, 81–92. (doi:10.1890/0012-9658(1997)078[0081:CIR LAG]2.0.CO;2)
7. McCune, B. & Allen, T. F. H. 1985 Will similar forests develop on similar sites? Can. J. Bot. 63, 367–376. (doi:10.1139/b85-043)
8. Jenkins, D. G. & Buikema Jr, A. L. 1998 Do similar communities develop in similar sites? A test with zooplankton structure and function. Ecol. Monogr. 68, 421–443. (doi:10.1890/0012-9615(1998)068[0421:DSCDIS]2.0.CO;2)
9. Jenkins, D. G. 2006 In search of quorum effects in metacommunity structure: species co-occurrence analyses. Ecology 87, 1523–1531. (doi:10.1890/0012-9658(2006) 87[1523:ISOQEI]2.0.CO;2)
10. Jenkins, D. G. 2011 Ranked species occupancy curves reveal common patterns among diverse metacommunities. Glob. Ecol. Biogeogr. 20, 486–497.(doi:10.1111/j.1466-8238.2010.00617.x)
11 Ng, I. S. Y., Carr, C. & Cottenie, K. 2009 Hierarchical zooplankton metacommunities: distinguishing between high and limiting dispersal mechanisms. Hydrobiologia 619, 133–143. (doi:10.1007/s10750-008-9605-8)
12. Ng, I. S. Y., Carr, C. & Cottenie, K. 2009 Hierarchical zooplankton metacommunities: distinguishing between high and limiting dispersal mechanisms. Hydrobiologia 619, 133–143. (doi:10.1007/s10750- 008-9605-8)
13. Gurevitch, J. & Padilla, D. K. 2004 Are invasive species a major cause of extinctions? Trends Ecol. Evol. 19, 470–474. (doi:10.1016/j.tree.2004.07.005)
14 MacDougall, A. S. & Turkington, R. 2005 Are invasive species the drivers or passengers of change in degraded ecosystems? Ecology 86, 42–55. (doi:10.1890/04-0669)
15 Sax, D. F. et al. 2007 Ecological and evolutionary insights from species invasions. Trends Ecol. Evol. 22, 465–471. (doi:10.1016/j.tree.2007.06.009)
16 Fridley, J. D., Stachowicz, J. J., Naeem, S., Sax, D. F., Seabloom, E. W., Smith, M. D., Stohlgren, T. J., Tilman, D. & Von Holle, B. 2007 The invasion paradox: reconciling pattern and process in species invasions. Ecology 88, 3–17. (doi:10.1890/0012-9658 (2007)88[3:TIPRPA]2.0.CO;2)
17. Sepkoski JJ. 1978 A kinetic model of Phanerozoic taxonomic diversity. I. Analysis of marine orders.Paleobiology 4, 223–251.
18. Sepkoski JJJ. 1979 A kinetic model of Phanerozoic taxonomic diversity. II. Early Phanerozoic families and multiple equilibria. Paleobiology 5, 222–251. (doi:10.2307/2400257)
19. Sepkoski JJJ. 1984 A kinetic model of Phanerozoic taxonomic diversity. III. Post-Paleozoic families and mass extinctions. Paleobiology 10, 246–267.
20. Marshall, C. R., & Quental, T. B. (2016). The uncertain role of diversity dependence in species diversification and the need to incorporate time-varying carrying capacities. Philosophical Transactions of the Royal Society B: Biological Sciences, 371(1691), 20150217.


