Tabela de conteúdos
Ensaios de 2014
Estados alternativos no Cerrado e o uso de fogo na manutenção da resiliência
Paula Zaterka Giroldo
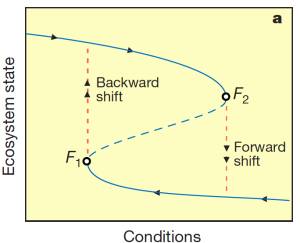
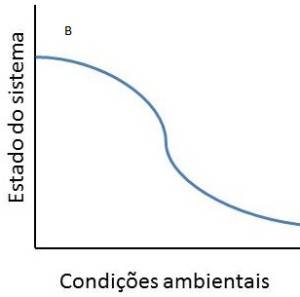
Transições críticas e mudanças bruscas foram constatadas em sistemas biológicos, físicos, econômicos e sociais sob a luz da teoria de sistemas dinâmicos, uma área da matemática usada para descrever a interação entre inúmeros tipos de processos (Scheffer, 2009). Esta teoria fornece ferramentas para a descrição e entendimento do comportamento de sistemas que apresentam estados múltiplos (Fig. 11) ), dentre os quais sistemas biológicos.
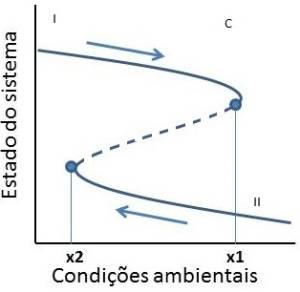
Ao contrário de sistemas que apresentam transições graduais, sistemas com estados múltiplos ou alternativos apresentam transições “catastróficas” entre estados estáveis de um sistema. A transição catastrófica entre estados alternativos ocorre a partir de um limiar crítico que promove o colapso do equilíbrio estável. Note, entretanto, que as condições responsáveis pelas transições entre estados alternativos (“forward shift” e “backward shift”) possuem valores diferentes (F1 e F2, respectivamente) e ocorrem sob condições críticas distintas, fenômeno conhecido por histerese (Scheffer et al. 2001; Scheffer, 2009). Esse conceito é importante, pois revela que a transição “catastrófica” não é facilmente revertida (Scheffer, 2009).
O modelo demonstra que para determinado conjunto de condições dois ou mais estados alternativos de um sistema podem existir e que a perda de resiliência pode ser um indicador da proximidade do limiar catastrófico (Scheffer et al., 2009). Nesse sentido, manter a resiliência do estado de um sistema seria uma das maneiras de afastá-lo dos limiares de mudança de estado (Folke et. al, 2004), garantindo a sua conservação.
A existência de estados alternativos em sistemas biológicos foi constatada em diferentes escalas espaciais e destacam-se os estudos em macro escala com recifes de coral (Knowlton, 1992), desertos (deMenocal et al., 2000), florestas de Kelp (Konar & Estes, 2003) e florestas (Hirota et al., 2011). Hirota e colaboradores (2011), por exemplo, analisaram a distribuição de cobertura florestal na África, América do Sul e Austrália e encontraram forte evidência de que florestas, savanas e campos são estados múltiplos de um mesmo sistema, sendo que a resiliência dos estados depende principalmente da precipitação.
Quando este estudo é projetado no modelo teórico, portanto, florestas e savanas são estados alternativos de um mesmo sistema e um determinado limiar de precipitação promove a transição catastrófica de cobertura florestal. Neste caso uma ação de manejo – como garantir a chegada de água no sistema (simulando a precipitação) – demonstra a histerese, já que regar uma formação savânica não garante que ela se transforme em uma formação florestal.
Se por um lado podemos reconhecer estados alternativos em uma escala continental ou global, também podemos reconhecer a existência de estados alternativos dentro de grandes formações vegetais. No caso de fisionomias savânicas, por exemplo, outros fatores como o fogo e a herbivoria determinam suas fisionomias (Dublin et al., 1990; Van Langevelde et al., 2003; Hoffmann et al. 2012; Pausas, 2015). Evidências demonstram que fisionomias de Cerrado são estados alternativos de um mesmo sistema e que os limiares estão relacionados a características funcionais e filogenéticas associadas com diferentes regimes de fogo 2) (Dantas et al. 2013). É fundamental, entretanto, que estudos sobre estados alternativos no Cerrado sejam realizados para determinar se de fato esse escopo teórico pode ser aplicado às fisionomias e, se sim, para determinar qual a condição - fogo, solo, água - e quais os limiares que desencadeiam as transições.
O fogo, em especial, é um fator ecológico essencial nas savanas e promotor de sua evolução (Bond et al., 2005). No Cerrado brasileiro a incidência de incêndios remonta a milhares de anos, como é revelado por amostras de carvão datadas entre 27 e 41 mil anos atrás (Vicentini, 1993), ou mesmo milhões de anos, como sugerem evidências biológicas (Simon et al., 2009). Inúmeras estratégias adaptativas ao fogo frequente são reconhecidas na vegetação nativa do Cerrado (Coutinho 1990; Guedes 1993; Medeiros 2002) e a maior parte de suas fisionomias são consideradas como ecossistemas dependentes do fogo (Hardesty et al., 2005; Pivello, 2011), o que significa que a manutenção de espécies e de processos ecológicos está diretamente ligada à ocorrência de queimadas.
Devido à crescente descaracterização dos regimes naturais de incêndio nos ecossistemas que dependem dele (Hardesty et al., 2005; Pivello, 2011), organizações internacionais têm chamado atenção para a importância de queimadas na conservação desses sistemas e para o estabelecimento de manejo com fogo adequado (Myers, 2006). Apesar de pouco usual no Brasil, o manejo com fogo é utilizado mundo afora e é apontado como uma alternativa no controle de plantas e patógenos indesejáveis (Young et al., 1999; Zimdahl, 1999; Stolle et al., 2003; DiTomaso et al., 2006), na manutenção de comunidades vegetais (Wright & Bailey 1982; Bunting et al. 1987; Pivello, 1992; Pivello, 2006a), na redução de material combustível para evitar incêndios (Pivello, 1992; Williams et al., 1999; Fernandes & Botelho, 2003; Pivello, 2006b) e para restaurar regimes de fogo (Bonnicksen & Stone, 1985; Baker, 1994; Pivello, 2011). O fogo, portanto, poderia ser utilizado a fim de garantir a resiliência do estado de um sistema dependente de queimadas.
A presença de espécies invasoras exóticas é um dos fatores responsáveis pela intensificação de mudanças na composição, estrutura e nos processos naturais no Cerrado, especialmente no regime de fogo (D’Antonio, 2000; Brooks et al., 2004; Gorgone-Barbosa et al., 2014). Estas espécies atingem alta densidade e dominância nas comunidades invadidas alterando a composição do solo, ciclagem de nutrientes, produtividade, microclima, disponibilidade de luz, biomassa, água e alimento para a fauna nativa (D’Antonio & Vitousek, 1992; Hughes & Vitousek, 1993; Mack et al., 2000), fazendo com que a utilização de queimadas prescritas não seja tão trivial.
Plantas nativas e exóticas tendem a responder de maneiras distintas à freqüência e intensidade das queimadas. A princípio é esperado que espécies invasoras apresentem vantagens em relação às espécies nativas na ausência do fogo, mas não na presença do fogo (Freckleton, 2004). A queimada pode, por exemplo, diminuir a fecundidade e inibir o desenvolvimento das sementes de algumas espécies exóticas, favorecendo as nativas (Gillespie & Allem, 2004). No entanto, quando é o caso de espécies invasoras oriundas de ecossistemas dependentes de fogo, queimadas podem estimular o seu crescimento. Este é o caso de uma das espécies invasoras mais agressivas no Cerrado, de origem africana e popularmente conhecida como Brachiária (Urochloa decumbens) (D´Antonio & Vitousek, 1992; Filgueiras, 1990).
O uso do fogo como estratégia de manejo em áreas protegidas está previsto na legislação brasileira, mas a sua utilização ainda é uma questão polêmica. Como consequência, há uma grande lacuna no conhecimento das respostas da vegetação nativa e exótica à queima. Integro atualmente um grupo de pesquisa que pretende explorar, entre outras questões, o uso do fogo como estratégia de manejo em áreas de Cerrado com a presença e ausência de espécies invasoras. Dentro desse contexto, me proponho a trabalhar com queimadas experimentais para avaliar o efeito da sazonalidade do fogo na comunidade nativa de Cerrado, contribuindo com a expansão da base de conhecimento sobre efeitos do fogo no Cerrado e avaliando o potencial do uso de queimadas prescritas como estratégia de manejo. Dada frequência e época adequadas, o uso de queimadas prescritas poderia garantir a manutenção da resiliência do sistema e exercer controle sobre a invasão, diminuindo a dominância das invasoras e aumentando a diversidade de espécies nativas, principalmente em ambientes naturalmente susceptíveis ao fogo (D’ Antônio 2000; Pivello 2006). Em condições inadequadas, entretanto, poderia facilitar a invasão. Diante desta situação é indispensável que se promova a experimentação in loco para fornecer as informações ainda desconhecidas e necessárias ao manejo e conservação das comunidades nativas de Cerrado.
Agradecimentos Obrigada a Vânia e Alessandra pela paciência e orientação e aos amigos Vitor, Diana e Gabi pelas sugestões!
Referências Bibliográficas
BAKER W.L. 1994. Restoration of landscape structure altered by fire suppression. Conservation Biology 8:763–769.
BONNICKSEN T.M. & STONE E.C. 1985. Restoring naturalness to national parks. Environmental Management 9:479–486. Bradstock.
BUNTING S.C., KILGORE B.M. & BUSHEY C.L. 1987. Guidelines for pre- scribed burning sagebrush-grass rangelands in the northern Great Basin. General Technical Report INT-231. USDA Forest Service, Intermountain Research Station, Ogden, Utah.
COUTINHO L.M. 1990. Fire in the ecology of Brasilian cerrado. In. J. G. Goldamer (ed.) Fire in the tropical biota ecosystem processes and global challenges. p. 273-291. Springer-Verlag. Berlim, Germany.
D’ANTONIO, C.M. & VITOUSEK, P.M. 1992. Biological invasions by exotic grasses, the grass/fire cycle, and global change. Annual Review of Ecology and Systematics 23: 63-87.
D’ANTONIO, C.M. 2000. Fire, plant invasions and global change. In: Invasive species in a changing world (ed. H. A. Mooney & R. J. Hobbs). Washington, DC: Island Press.
DANTAS V., BATALHA, M.A. & PAUSAS J.G. 2013. Fire drives functional thresholds on the savanna-forest transition Ecology 94:2454-2463.
DEMENOCAL, P.; ORTIZ, J.; GUILDERSON, T.; ADKINS, J.; SARNTHEIN, M.; L. BAKER & M. YARUSINSKY. 2000. Abrupt onset and termination of the African Humid Period: rapid climate responses to gradual insolation forcing. Quaternary Science Reviews, 19:347-361.
DITOMASO J.M., BROOKS M.L., ALLEN E.B., MINNICH R., RICE P.M. & KYSER G.B. 2006. Control of invasive weeds with prescribed burning. Weed Technology. 20: 535-48.
FERNANDES P. M. & BOTELHO H. S.. 2003. A review of prescribed burning effectiveness in fire hazard reduction. International Journal of Wildland Fire 12:117–128.
FILGUEIRAS, T.S. 1990. Africanas no Brasil: Gramíneas introduzidas da África. Cad.
FOLKE, C.; CARPENTER, S.; WALKER, B.; SCHEFFER, M.; ELMQVIST, T.; L. GUNDERSON & C.S. HOLLING. 2004. Regime shifts, resilience, and biodiversity in ecosystem management. Annu. Rev. Ecol. Evol. Syst., 35:557-581.
FRANK VAN LANGEVELDE, CLAUDIUS A. D. M. VAN DE VIJVER, LALIT KUMAR, JOHAN VAN DE KOPPEL, NICO DE RIDDER, JELTE VAN ANDEL, ANDREW K. SKIDMORE, JOHN W. HEARNE, LEO STROOSNIJDER, WILLIAM J. BOND, HERBERT H. T. PRINS, AND MAX RIETKERK 2003. Effects of fire and herbivory on the stability of savanna ecosystems. Ecology 84:337–350
FRECKLETON, R.P. 2004. The problems of prediction and scale in applied ecology: the example of fire as a management tool. Journal of Applied Ecology 41: 599 – 603. Geociências 5:57-63.
GILLESPIE, I.G. & ALLEM, E.B. 2004. Fire and competition in a Southern California grassland: impacts on the rare forb Eradium macrophyllum. Journal of Applied Ecology 41: 643-652.
GORGONE-BARBOSA, E. ; PIVELLO, V.R. ; BAUTISTA, S. ; ZUPO, T. ; RISSI, M.N. ; FIDELIS, ALESSANDRA . How can an invasive grass affect fire behavior in a tropical savanna? A community and individual plant level approach. Biological Invasions , v. 17, p. 423-431, 2015.
GUEDES D. M. 1993. Resistência das árvores do cerrado ao fogo: papel da casca como isolante térmico. Brasília, UnB, 1993. Dissertação (Mestrado em Ecologia) – Universidade de Brasília.
HARDESTY J., MYERS R., & FULKS W. 2005. Fire, ecosystems, and people: a preliminary assessment of fire as a global conservation issue. The George Wright Forum, 22: 78-8.
HIROTA, M.; HOLMGREN, M.; E.H. VAN NES & M. SCHEFFER. 2011. Global Resilience of Tropical Forest and Savanna to Critical Transitions. Science, 334:232-235.
HOLLY T. DUBLIN, A.R.E. SINCLAIR AND J. MCGLADE. 1990. Elephants and Fire as Causes of Multiple Stable States in the Serengeti-Mara Woodlands Journal of Animal Ecology. Vol. 59, No. 3. 1147-1164.
HUGHES, R.F. & VITOUSEK, P.M. 1993. Barries to shrub reestablishment following fire in the seasonal submontane zone of Hawai’i. Oecologia. 93: 557-563.
KNOWLTON N. 1992. Thresholds and multiple stable states in coral reef community dynamics. Am Zool 32:674-82.
KONAR, B. & J.A. ESTES. 2003. The stability of boundary regions between kelp beds and deforested areas. Ecology, 84:174–178.
MACK, R.N; SIMBERLOFF, D; LONDSDALE, W.M.; EVANS, H; CLOUT M. & BAZZAZ, F.A. 2000. Biotic invasions: causes, epidemiology, global consequences, ando control. Ecological Applications 10: 689-710.
MEDEIROS M. B. 2002. Efeitos do fogo nos padrões de rebrotamento em plantas lenhosas, em campo sujo. Brasília: UnB, 2002, 122p. Tese de Doutorado. Universidade de Brasília.
MYERS R.L. 2006. Convivendo com o Fogo — Manutenção dos Ecossistemas e Subsistência com o Manejo Integrado do Fogo. Tradução de Margaret Batalha. The Nature Conservancy - Iniciativa Global para o Manejo do Fogo. Tallahassee, USA.
PAUSAS, J.G. 2015. Alternative fire-driven vegetation states. Journal of Vegetation Science 26: 4-6
PIVELLO V.R. 1992. An expert system for the use of prescribed fires in the management of Brazilian savannas. Tese de Doutorado. Ascot, Inglaterra, Imperial College Centre for Environmental Technology, University of London.
PIVELLO V.R. 2006a. Manejo de fragmentos de cerrado: princípios para a conservação da biodiversidade. In: Cerrado: ecologia, biodiversidade e conservação. A. Scariot, J. C. Sousa Silva & J. M. Felfili (Eds.). Ministério do Meio Ambiente, Brasília, DF. pp.402-413.
PIVELLO V.R. 2006b. Fire management for Biological Conservation in the Brasilian Cerrado. In: J. Mistry & A. Berardi, Savanas and Dry Forests - Linking People with Nature. Ashgate, Hants. pp. 129-154.
PIVELLO V.R. 2011. The use of fire in Brazil: past and present. Fire Ecology, 7: 24-39.
SCHEFFER, M. 2009. Critical Transitions in Nature and Society, Princeton University Press.
SCHEFFER, M.; CARPENTER, S.R.; FOLEY, J.A.; C. FOLKE & B. WALKER. 2001. Catastrophic shifts in ecosystems. Nature, 413: 591-596.
SCHEFFER, MARTEN; BASCOMPTE, J. BROCK, W. A; et al. Early-warning signals for critical transitions. Nature, v. 461, n. 7260, p. 53-9, 3 set 2009.
SIMON M.F., GRETHER R., QUEIROZ L.P., SKEMA C., PENNINGTON R.T. & HUGHES, C.E. 2009. Recent assembly of the cerrado, a neotropical plant diversity hotspot, by in situ evolution of ad aptations to fire. Proceedings of the National Academy of Science, 106: 20.359-20.364.
STOLLE F., CHOMITZ K. M., LAMBIN E. F., & TOMICH. T. P. 2003. Land use and vegetation fires in Jambi Province, Sumatra, Indonesia. Forest Ecology and Management 179:277–292.
VICENTINI K. R. F. 1993.Análise Palinológica de uma Vereda em Cromínia-GO. Brasília: UnB, 1993. Dissertação (Mestrado em Ecologia) – Universidade de Brasília.
WILLIAMS R. J., COOK G. D., GILL A. M., & MOORE P. H. R. 1999. Fire regime, fire intensity and tree survival in a tropical savanna in northern Australia. Australian Journal of Ecology 24:50–59.
WRIGHT H. A. & BAILEY A. W. 1982. Fire ecology: United States and southern Canada. Wiley-Interscience, New York.
YOUNG III W. C., MELLBYE M. E. & T. B. SILBERSTEIN. 1999. Residue management of perennial ryegrass and tall fescue seed crops. Agronomy Journal 91:671–675.
ZIMDAHL R. L. 1999. Fundamentals of weed science. Academic Press, San Diego, California. 284.
“Pegada e caminho”, Processos históricos e biogeográficos
Daniel Andrés Chirivi Joya
Podemos pensar nos processos históricos biogeográficos como o conjunto de eventos que têm acontecido para gerar as distribuições atuais das espécies sobre o planeta, e as distribuições que se apresentaram no passado (Crisci, 2001), é como uma historia da qual somente conhecemos pequenos relatos isolados e algumas consequências evidenciáveis. Qual foi o caminho recorrido para que as populações e comunidades tenham chegado ate o ponto atual, e quais processos tiveram maior influência nesse resultado? Esta pergunta constitui a base para compreender como evoluiu a diversidade sobre o planeta e como evoluirá no futuro (Monge, 2008). Como pensaria qualquer bom pesquisador, o ideal é procurar as pegadas que ainda são visíveis para traçar uma hipótese de caminho; porém, o que acontece como aquelas pegadas que têm sido apagadas pelos ires e vires da historia? Ou, que podemos fazer quando encontramos uma grande quantidade de pegadas que parecem coincidir em espaço, mas não em tempo ou direção? O tempo em que formam feitas essas pegadas, e sua direção pode alterar a versão da historia que contamos, assim também o fato de não saber se essas pegadas correspondem ao mesmo “sujeito” ou um mesmo processo (Ronquist & Sanmartin, 2011). Uma opção é achar padrões dentro destes processos, nenhuma historia é sempre igual, portanto, saber exatamente como aconteceu cada evento, como se formou cada comunidade poderia resultar extremamente difícil, ainda assim, se podemos achar uma linha lógica dentro da qual interagem todos os processos, poderíamos explicar boa parte da historia, as linhas do curso recorrido (Ronquist & Sanmartin, 2011).
Darwin e Wallace começaram a estudar as distribuições das espécies ao redor do planeta, percebendo alguns padrões na distribuição que foram importantes para o desenvolvimento da teoria evolutiva (Ronquist & Sanmartin, 2011), nesta tarefa se começa a relacionar geografia, diversidade e evolução o qual consolidou o que conhecemos como biogeografia (Crisci, 2001). Esta ciência que tem sido abordada desde uma grande variedade de perspectivas, as quais podem se agrupar em duas correntes: biogeografia histórica, combinando filogenia e geografia, na qual se avalia a historia evolutiva das linhagens, em relação a eventos e padrões geográficos; e a biogeografia ecológica, incorporando conceitos como grupos funcionais e constantes ambientais, nas quais se incorpora o conceito nicho e as dinâmicas de populações e comunidades os quais se associam as condições geográficas (Posadas et. al., 2006; Wiens & Donoghue, 2004). Estas visões se desenvolveram separadas, a biogeografia ecológica procura explicações determinísticas a uma escala temporal curta incluindo interações entre as espécies e o ambiente, em quanto, a biogeografia histórica tenta analisar escalas temporais maiores considerando somente a evolução de linhagens que são afetadas pelas mudanças geográficas (Posadas et. al., 2006). Ainda que no começo estas fossem duas visões conflitantes, nos últimos anos os pesquisadores perceberam a importância de fazer uma síntese que incorpore historia filogenética e processos ecológicos, como ferramenta na busca do entendimento processos históricos biogeográficos (Wiens & Donoghue, 2004). Algumas teorias atualmente integram as duas áreas da biogeografia, um exemplo claro é o “nicho conservado” que propõe que algumas características do nicho se conservam a traves da filogenia, limitando assim as possíveis dispersões das espécies (Machac et. al., 2011); alguns pesquisadores também avaliam a evolução das características morfológicas ou fisiológicas em resposta ao ambiente, e sua evolução dentro da filogenia (Gaston et. al. 2008). Com uma perspectiva de uma biogeografia unificada a ecologia pode incorporar os processos históricos biogeográficos como uma parte fundamental na unificação da teoria ecológica (Monje, 2008).
Os processos históricos biogeográficos são para a ecologia as interações entre os processos ecológicos, históricos e geográficos e ecológicos que definem a distribuição das espécies no espaço e desta forma também a estrutura das comunidades, e do conjunto de comunidades (Monje, 2008). Uma das grandes dificuldades é entender como integrar os processos que acontecem a escalas espaciais diferentes (globais, regionais e locais) (Riclefs, 1987), a traves de varias pesquisas tem sido possível ver como os processos que acontecem nestas diferentes escalas influem de jeitos diferentes tanto na diversidade local como na diversidade regional, por tanto, não é coerente procurar uma explicação somente em uma delas (lessard et. al., 2012; Harrison & Cornell, 2008). A especiação, competição, dispersão entre outros eventos que determinam a diversidade local, em conjunto, acabam definindo a diversidade regional, e em resposta a diversidade regional atua como uma fonte de espécies que afeta a diversidade local (Cornell, 1895).
Levando em conta o anterior, podemos imaginar os processos locais como pequenos pontos de divergência que aportam variação individualmente na distribuição das espécies, e, que em conjunto acabam formando a grande estrutura das comunidades numa escala regional, ou global mesmo (Cornell, 1895); no mesmo tempo processos geográficos acontecem constantemente, mudando as condições regionais e em consequência as condições locais e suas dinâmicas; ainda que esta ideia seja simples, é nela onde se encontra a chave para integrar a biogeografia numa teoria ecológica geral (lessard et. al., 2012; Harrison & Cornell, 2008). As condições geográficas do planeta são de um modo simples o cenário onde acontecem as interações entre comunidades, qualquer processo que seja descrito nesta teoria ecológica, é limitado e condicionado pelas condições da área onde acontece, direcionando assim as possíveis respostas a estas dinâmicas no nível de espécie, população, comunidade e metacomunidade.
Desde alguns anos atrás os ecólogos têm começado a procurar uma teoria ecológica geral que permita estabelecer padrões na evolução das comunidades e da diversidade, esta grande teoria se baseia em quatro tipos de processos: seleção, deriva, especiação e dispersão; os quais podem acontecer em escala regional, local e global (Vellend, 2010). Para integrar os processos históricos biogeográficos nesta grande teoria ecológica é importante identificar onde fazer a conexão com os anteriores quatro processos, e isto ainda não está muito claro; Vellend (2010) apresenta a ideia de que as dinâmicas locais, regionais e globais se influenciam mutuamente a traves da dispersão, assim, este processo funciona como um transportador de informação (indivíduos, espécies, populações, variabilidade genética etc.) entre as comunidades, e o conjunto de comunidades que podemos definir como metacomunidade (leiboldt, 2004). Se as comunidades fossem exatamente iguais em condições ambientais ou espaço, não seria difícil que começaram a se homogeneizar com o passo do tempo pois a competição favoreceria aos melhores competidores os quais se dispersariam e estabeleceriam exitosamente em todas as comunidades, porém, as variações geográficas que existem ao redor do planeta exercem limitações para esta homogeneidade e geram cenários de competição diferentes, nichos diferentes, assim mesmo uma variação na distribuição (Machac et. al., 2011).
As interações entre as dinâmicas das comunidades e as dinâmicas geográficas são responsáveis da distribuição da diversidade no planeta (Harrison & Cornell, 2008; Wiens & Donoghue, 2004). Este conceito pode virar muito mais complexo se pensamos que não somente as condições ambientais podem afetar ou condicionar a distribuição das espécies, mas, as espécies podem gerar condições ambientais especificas, desde pequenos microambientes, até mudanças tão drásticas como a que aconteceu com aparição dos organismos geradores de oxigênio. Com estas ideias na mente, podemos começar a procurar alternativas de integração dos quatro processos da teoria ecológica, dentro da biogeografia. Baseado nos conceitos de metacomunidades que se tem utilizado nos recentes anos (leiboldt, 2004), seria possível estabelecer modelos onde as condições geográficas e ambientais não fossem iguais entre as comunidades (e dizer: diferentes K, diferentes taxas de dispersão e condições ambientais). Deste jeito se incluiriam dispersão e seleção dentro dum cenário geográfico (Ronquist & Sanmartin, 2011). A deriva por sua parte é um conceito difícil de medir, Vellend (2010), apresenta uma revisão com estudos que mostram a importância da deriva em condições de equivalência ecológica, porém, este processo é estocástico tem que se tratar como altamente variável em qualquer modelo.
Finalmente a história filogenética dos organismos tem muito a ver com o ultimo processo da teoria ecológica, a especiação. Ainda que as condições ambientais, dispersão, e seleção e deriva determinam se uma espécie se estabelece ou não num lugar, é o ponto de origem das linhagens e sua evolução quem estabelece o curso recorrido (Wiens & Donoghue, 2004). Não importa se um lugar tem as condições para o estabelecimento de uma espécie, se a espécie é incapaz de chegar até lá desde seu ponto de origem, também é importante levar em conta que durante o processo de dispersão as linhagens podem apresentar adaptações a novas condições ambientais e novidades geográficas, os processos de especiação são os pontos de origem de cada linhagem, e são os outros três processos aqueles que determinam seu curso, sempre dentro de um marco de eventos geográficos.
Algumas linhagens podem nos ajudar a obter “pegadas” na descrição dos processos históricos biogeográficos, assim ao descobrir a historia de estas podemos descobrir a historia de muitas outras espécies. Este é o caso de linhagens conservadas no tempo (Sharma & Giribet, 2012), é interessante é útil perceber como estas linhagens têm coexistido com diferentes espécies e dentro de comunidades totalmente diferentes, com um ambiente que tem mudado drasticamente em vários momentos da historia. Este é o caso de alguns aracnídeos e em particular dos Amblypygi. Estes artrópodes, desconhecidos para a maioria de pessoas, tem se mantido quase invariáveis na sua morfologia desde o carbonífero ate nossos dias, sua distribuição e muito ampla, ao redor do tropico, é são importantes em ecossistemas de cavernas (Weygoldt, 2000).
Minha pesquisa, ainda que não seja ecológica, tem a ver com os processos históricos biogeográficos anteriormente descritos, o gênero Phrynus é um grupo de amblypígios praticamente restringido a America, e que se distribui amplamente desde Estados Unidos até America do sul em Brasil (Quintero, 1981). Este grupo, ainda não foi revisado e também não se conhece sua filogenia (Harvey, M. S. 2007; Quintero, 1981), as semelhanças morfológicas entre as espécies fazem com que se assuma que sua ecologia é igual, e mesmo no existem muitos trabalhos sobre as interações inter-especificas do grupo e praticamente nenhum sobre seu papel nas comunidades (Weygoldt, 2000). Objetivo do trabalho, é conhecer a distribuição das espécies do grupo, e descobrir sua historia filogenética, isto como base de um programa de pesquisa o qual tem o objetivo de desvelar a historia evolutiva do grupo. Levando em conta as nossas conclusões anteriores, não podemos conhecer esta historia somente com biogeografia histórica, é preciso conhecer a historia ecológica. No processo de minha pesquisa é importante incluir os conceitos de processos biogeográficos que estão, como já temos visto, unidos a teoria geral da ecologia. É importante observar ás espécies deste grupo não somente como uma linhagem, mas como uma linhagem dentro de uma dinâmica de comunidades.
Provavelmente os Phrynus tiveram sua origem em America central, e diversificaram a traves das diferentes ilhas do caribe já que sua maior diversidade está concentrada ali (Armas, 2014). Desde o Carbonífero a geografia Americana tem sofrido muitas mudanças, os Amblypygios ao parecer não são dispersores muito eficientes, porém se tem mantido exitosamente coexistindo com espécies do mesmo gênero, da mesma família e incluso outros aracnídeos (Weygoldt, 2000). Até agora o caminho recorrido por este gênero é totalmente desconhecido, o conhecimento das espécies existentes sua distribuição e filogenia, são as primeiras pegadas que se estão tentando coletar; as espécies desde grupo têm diversificado, dispersado, e interatuado com comunidades diferentes, incluso com espécies já extintas. Conhecer os processos históricos biogeográficos que ocorreram com este grupo, pode não somente dar uma ideia de como tem evoluído os amblypygi em America, mas de como evoluíram as comunidades ás quais pertenceram e qual é a situação deste grupo no presente.
Referências bibliográficas
Armas, L. F. 2014. Los Amblypygios de Cuba (Arachnida: Amblypygi). Revista Ibérica de Aracnología, 24: 29-51.
Cornell H.V. 1985. Local and regional richness of Cynipine gall wasps on California oaks. Ecology, 66: 1247-1260
Crisci, J.V. 2001. The voice of historical biogeography. Journal of Biogeography, 28: 157-168.
Leibold, M., Holyoak, M., Mouquet, N., Et al. 2004. The metacommunity concept: a framework for multi-scale community ecology, 7: 601-613
Gaston, K., Chown, S. & Evans, K. 2008. Ecogeographical rules: elements of a synthesis. Ecology Letters, Journal of Biogeography, 35: 483-500.
Lessard, J., Borregaard, M., Fordyce, J. Et. al. 2012. Strong influence of regional species pools on continent-wide structuring of local communities. Proceedings of the royal society, 279: 266-274.
Harrison, S. & Cornell, H .2008. Toward a better understanding of the regional causes of local community richness. Ecology Letters, 11: 969-979.
Harvey, M. S. 2007. The smaller arachnid orders: diversity, descriptions and distributions from Linnaeus to the present (1758 to 2007). Zootaxa, 1668, 367-380.
Machac, A., Zrzavy, J., & Storch, D. 2011. Range Size Heritability in Carnivora Is Drivenby Geographic Constraints. The american naturalist, 177 (6): 767-779.
Monge-Nájera, J. 2008. Ecological biogeography: a review with emphasis on conservation and the neutral model. Gayana, 72(1): 102-112.
Posadas, P., Crisci, J. & Katinas, L .2006. Historical biogeography: A review of its basic concepts and critical issues. Journal of Arid Environments , 66: 389-403.
Quintero, D. 1981. The Amblypygid genus Phrynus in the Americas (Amblypygi, Phrynidae). Journal of Arachnology, 9: 117-166.
Ricklefs, R. E. 1987. Community diversity: relative roles of local and regional processes. Science, 235: 167-171.
Ronquist, F., & Sanmartin, I. 2011. Phylogenetic Methods in Biogeography. The Annual Review of Ecology, Evolution, and Systematics, 42: 441-464.
Sharma, P. & Giribet, G. 2012. Out of the Neotropics: Late Cretaceous colonization of Australasia by American arthropods. Proceedings of the royal society, 10: 1-9
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quaterly Review of Biology ,85: 183-206
Weygoldt, P. 2000. Whip Spiders (Chelicerata: Amblypygi) Their Biology, Morphology and Systematics. Apollo Books, Stenstrup, Denmark, 164 pp.
Wiens, J. & Donoghue, M. 2004. Historical biogeography, ecology and species richness. Trends in Ecology and Evolution, 9 (12): 639 -644.
Resiliência no Monitoramento de Longo Prazo
Bruno Lenhaverde Sandy
O termo resiliência foi introduzido na literatura em 1973 por um ecólogo teórico C. S. Holling no artigo “Resilience and stability of ecological systems” como um meio de entender a dinâmica não-linear observada nos ecossistemas. Desde esta época, o conceito estava relacionado com o termo “estabilidade” sendo transportado das áreas de Matemática e Física para entender sobre a diversidade biológica relacionada com as funções ecológicas (Peterson et. al., 1998). Ele foi definido na literatura de duas formas distintas (resiliência engenharia e resiliência ecológica), cada uma refletindo diferentes aspectos de estabilidade. Holling enfatizou estes diferentes aspectos de estabilidade para chamar atenção para a distinção entre eficiência e persistência; constância e alteração; predição e não-predição. E definiu como a capacidade de um sistema retornar ao seu estado de equilíbrio após um distúrbio.
Resiliência está ligada a definição de estados alternativos e vem sendo discutido desde a década de 60 por autores como (May, 1971; Rosenzweig & McArthur, 1961) onde mostravam-se duas perspectivas desenvolvidas para descobrir como comunidades mudam de um estado para outro. A resiliência ecológica enfatiza condições longe de qualquer condição de estado estável, ou seja, qualquer instabilidade pode fazer o sistema sair de seu estado atual para outro estado estável. E neste caso, a resiliência é calculada pela quantidade de distúrbios que pode ser absorvido pelo sistema, redefinido estruturas pelas mudanças nas variáveis bem como nos processos de comportamento (Holling, 1973). Já a “resilience engineering” pode ser definida pelo tempo de retorno para o estado de resiliência e foi transferido da Engenharia que buscava entender sistemas de funcionamento lineares. (Holling, 1996).
Uma importante distinção entre estes dois tipos está na existência de múltiplos estados alternativos estáveis. A resiliência ecológica presume a existência de múltiplos estados estáveis e a tolerância do sistema frente as perturbações que facilitam a transição de um estado estável para outro (Ludwig et. al., 1996). E está presente no ciclo adaptativo ou “modelo de quatro fases de Holling (1996)”, onde descreve como padrões e processos mudam ao longo do tempo nos ecossistemas, especialmente quando ocorrem distúrbios. Holling descreve resiliência ecossistêmica nas primeiras duas fases do ciclo (Exploitativa e Conservativa).
Durante a fase exploitativa a resiliência ecológica é grande, ou seja, o sistema é capaz de absorver grande parte do distúrbio. Quando o sistema está para atingir o seu limite de crescimento, ou seja, a capacidade de suporte, torna-se cada vez mais frágil, consequentemente a velocidade de crescimento e a oferta de alimentos diminuem possibilitando que um distúrbio afete de forma mais severa os indivíduos da comunidade. Autores como Brown, 1996; Sonn, 1998; Waller, 2001; Klein, 2003, aplicaram o termo resiliência em diversos níveis como físico, sistemas ecológicos, sociais, individuais, população, comunidade e global.
A América Latina inclui uma grande diversidade de ecossistemas marinhos (Miloslavick et. al., 2011) que estão ameaçados pelos efeitos das mudanças climáticas globais e outros impactos antrópicos nas regiões costeiras (Turra et. al., 2013), Esses impactos podem resultar em degradação, fragmentação, perda de habitats (Fraschetti et. al., 2008), alterações na composição e distribuição (Martins et. al, 2012) com consequente redução da biodiversidade em escala de espécie, hábitat ou mesmo ecossistema. A influência do homem sobre estes ecossistemas aumentou de maneira significativa, crescendo a um ritmo sem precedentes (Berchez et. al., 2008). Respostas específica são esperadas para cada habitat, relacionadas a reação de cada espécie e as interações sinérgicas dentro das unidades funcionais das comunidades (Burrows et. al., 2011). É essencial portanto que se incentivem e desenvolvam estudos de monitoramento para entender os efeitos das mudanças climáticas nesses ecossistemas, de forma a permitir a detecção precoce de alterações (Turra et. al., 2013).. Mesmo ao se considerar estudos temporalmente pontuais, apenas uma área surpreendentemente pequena das comunidades bentônicas de substrato consolidado do litoral do Brasil é conhecida (Ghilardi et al., 2008). Dados de séries temporais se fazem necessários a partir da criação de estações distribuídas por toda a costa brasileira (Turra et. al., 2013).
A nível de ecossistema, os marinhos como os costões rochosos, são submetidos a uma série de fatores causadores de estresse. Entre eles as atividades humanas, fatores ambientais naturais como ação das marés e ondas impactando outros níveis, originando alterações na estrutura da comunidade em diferentes escalas espaciais (Burrows et al., 2011). A velocidade em que os habitats estão sendo alterados vem sendo maior que a eficiência das iniciativas atuais para seu estudo (Norse & Crowder 2005). Logo, duas razões fundamentais para o monitoramento ambiental são: (I) para estabelecer linhas de base que represente o status atual dos componentes dos ecossistemas e; (II) detectar alterações ao longo do tempo, ou seja, todas as alterações que vão além das oscilações naturais do ambiente (H. Vaughan et. al., 2001).
Neste contexto, a partir das hipóteses contidas do meu projeto em que áreas de maior biodiversidade sejam mais afetadas e passem a apresentar maiores oscilações sazonais e, que o aumento na temperatura da água do mar possa alterar a distribuição espacial das espécies nativas, de modo que regiões biogeográficas conhecidas, poderiam ser alteradas globalmente; o conceito de resiliência ecológica juntamente com dados prévios do local - dados de análises de séries temporais (Hawkins et. al., 2008) auxiliariam na compreensão da dinâmica do costão rochoso, ou seja, se tal local está atualmente em um estado de equilíbrio estável ou a partir de variáveis mensuráveis com aquecimento do mar, o aumento na sua movimentação, do seu nível médio, a redução do pH ou alterações nutricionais (Berchez et. al., 2008) estaria transitando de um estado estável anterior para futuro.
Referências Bibliográficas
Berchez, F.; Amancio, C.E.; Ghilardi, N.P. & Oliveira, E.C. “Possíveis impactos das mudanças climáticas globais nas comunidades de organismos marinhos bentônicos da costa brasileira”. In: Buckeridge, M. (ed.) Biologia e mudanças globais no Brasil, São Carlos, ISBN: 978-85-7656-143-9, p. 167-180. 2008.
Burrows, M.T.; Schoeman, D.S.; Buckley, L.B; Moore, P.; and others. The Pace of Shifting Climate in Marine and Terrestrial Ecosystems. Science, 334: 652-655. 2011.
Brown, D., & Kulig, J. (1996/97). The concept of resiliency: Theoretical lessons from community research. Health and Canadian Society, 4, 29–52.
Drake JA. 1991. Community-assembly mechanics and the structure of an experimental species ensemble. Am Nat 137: 1–26.
Frashetti, S.; Terlizzi, A. & Boero, F. How many habitats are there in the sea (and where)?. Journal of Experimental Marine Biology and Ecology, (366): 109-115. 2008
Ghilardi, N. P.; Pereira Filho, G.H. & Berchez, F. Current knowledge status on the ecology of hard bottom benthic communities in Brazil and the need for new approaches. Oecologia Brasiliensis, 12: 197-205. 2008
Hawkins, S J, et al. “Complex interactions in a rapidly changing world: responses of rocky shore communities to recent climate change.” Climate research 37.2-3 (2008):123-133
Holling, C.S. 1973. Resilience and stability of ecological systems. Annual Review of Ecology and Systematics, 4: 1–23.
Holling CS. 1986. The resilience of terrestrial ecosystems: local surprise and global change In Sustainable Development of the Biosphere, ed. WC Clark, RE Munn, pp. 292–317. Cambridge: Cambridge Univ. Press.
Holling CS. 1996. Engineering resilience vs. ecological resilience. In Engineering Within Ecological Constraints, ed. PC Schulze, pp. 31–43.Washington, DC: Natl. Acad.
Ives AR. 1995. Measuring resilience in stochastic-systems. Ecol. Monogr. 65:217–33
Klein, R., Nicholls, R., & Thomalla, F. (2003). Resilience to natural hazards: How seful is this concept? Environmental Hazards, 5, 35–45.
Law R and Morton RD. 1993. Alternative permanent states of ecological communities. Ecology 74: 1347–61.
Lewontin RC. 1969. The meaning of stability. Brookhaven Symp Biol 22: 13–23
Ludwig D, Walker B, Holling CS. 1996. Sustainability, stability and resilience.Conserv. Ecol. 1:1–27
May, R. M. 1 971. Stability in multi-species community models. Matk Biosei. 1 2:59-79
Martins CDL, Arantes N, Faveri C et al. (2012) The impact of coastal urbanization on the structure of phytobenthic communities in southern Brazil. Marine Pollution Bulletin, 64, 772–778.
Miloslavich P, Klein E, D_ıaz JM et al. (2011) Marine biodiversity in the Atlantic and Pacific Coasts of South America: knowledge and gaps. PLoS ONE, 6, e14631.
Murray, S.N.; Ambrose, R.F. & Dethier, M.N. Monitoring rocky shores. University of California Press, Berkeley, 220p. 2006.
Norris, F.H., S.P. Stevens, et al. 2008. “Community resilience as a metaphor, theory, set of capacities, and strategy for disaster readiness’’. American Journal of Community Psychology, 41(1-2): 127- 150.
Norse, E.A., L.B. Crowder, K. Gjerde, D. Hyrenbach, C.M. Roberts, C. Safina & M.E. Soulé (2005). Place-based ecosystem management in the open ocean. Pp. 302-327 in E.A.
Norse & L.B. Crowder, eds. (2005) Marine Conservation Biology: The Science of Maintaining the Sea’s Biodiversity. Island Press, Washington DC.Rosenzweig, M. L., MacArthur, R. H. 1 963. Graphical representation and stability condition of predator-prey interactions. Am. Natur. 97:209-23
Sonn, C., & Fisher, A. (1998). Sense of community: Community resilient responses to oppression and change. Journal of Community Psychology, 26, 457–472.
Sutherland JP. 1974. Multiple stable points in natural communities. Am Nat 108: 859–73
Tilman D, Downing JA. 1994. Biodiversity and stability in grasslands. Nature 367:363–65
Turra, A.; Bernardino, A.F.; Amaral, A.C.Z.; Berchez, F; Creed, J.C.; Copertino, M. S; Schaeffer-Novelli, Y. & Coutinho, R. Rede de Monitoramento de Habitats Bentônicos Costeiros (ReBentos): histórico e estratégia de atuação. II Workshop da Rebentos, Salvador, CD Resumos. 2011.
Vaughan H., Brydges T., Fenech A., Lumb A. (2001). Monitoring long-term ecological changes through the ecological monitoring and assessment network: science-based and policy relevant. Environmental Monitoring and Assessment Kluwer Academic Publishers 67: 3–28.
Waller, M. (2001). Resilience in ecosystemic context: Evolution of the concept. American Journal of Orthopsychiatry, 71, 290–297.
Limitação de dispersão: o segredo da coexistência em comunidades arbóreas
Leticia Bolian Zimback
Em comunidades biológicas o conceito de dispersão é bastante abrangente. A dispersão pode referir-se ao movimento de migração de indivíduos de uma ilha para outra, representando um processo importante para a redução das taxas de extinção em habitats isolados (Teoria da Biogeografia de Ilhas - MacArthur & Wilson, 1967). Em contextos biogeográficos e\ou históricos, a dispersão, e também a especiação, são processos que adicionam espécies na comunidade em grandes escalas espaciais e temporais (Ricklefts, 1987). Por outro lado, em escala local, a dispersão é o processo que conecta comunidades locais em uma única metacomunidade (Leibold, 2009). Em comunidades vegetais, a dispersão ocorre através do movimento de propágulos reprodutivos, como as sementes. De forma geral, a dispersão corresponde ao movimento entre unidades espaciais (Loreau, 2000) influenciando a abundância das populações e, consequentemente, como as espécies interagem umas com as outras.
A dispersão é extremamente importante para a teoria ecológica, relaciona-se com a forma e frequência com que novas espécies ou indivíduos chegam a determinadas comunidades e, também com a manutenção das espécies e coexistência entre elas (Vellend, 2010). Pensando em comunidades vegetais, a dispersão de sementes é um processo muito importante para a dinâmica e regeneração da comunidade. Através da dispersão, as sementes podem chegar a locais propícios para germinar e se estabelecer. Da mesma maneira, as sementes podem atingir locais onde o seu estabelecimento não seja possível. Assim, esse processo faz com que as taxas de crescimento populacional e a abundância das espécies sejam controladas e a chegada de sementes seja espacialmente limitada dentro da comunidade.
A limitação de dispersão é a proporção de sítios que uma semente de uma determinada espécie pode alcançar dentro de todo o espaço físico da comunidade (Muller-Landau et al. 2002). Alta limitação de dispersão indica que a ocorrência da espécie é fortemente limitada pela dispersão das suas sementes. Nesse caso a chegada da semente costuma ser um evento determinístico e restrito a poucos locais onde a diversidade provavelmente será baixa. Dessa maneira, a comunidade como um todo é um conjunto de sítios que se diferem estocasticamente com relação a composição de espécies (Hurtt e Pacala, 1995). Isso aumenta a competição intraespecífica porque os propágulos se distribuem de forma mais agregada, mas por outro lado, diminui a interespecífica permitindo a coexistência regional entre as espécies (Pacala e Levin, 1997).
Diferentes limitações de dispersão entre as espécies faz com que as piores competidoras consigam atingir locais que as melhores competidoras não podem chegar, isso faz com que as espécies coexistam e a comunidade não se torne monodominante. A análise da dispersão das sementes em várias escalas dentro da comunidade é importante para entender justamente como essa comunidade mantém a sua diversidade. Segundo a terminologia de Whittaker (1972), a diversidade de uma comunidade pode ser subdividida em alfa (local), beta (diferença entre diferentes sítios da comunidade) e gama (diversidade regional da comunidade como um todo, leva em conta alfa e beta). Assim, as diferentes histórias de vida e limitações de dispersão de cada espécie da comunidade geram um balanço entre as diversidades alfa e beta (Loreau, 2000) e ajudam a entender melhor a dinâmica espacial das comunidades e a coexistência entre as espécies.
A dispersão de sementes é um processo essencial em comunidades vegetais. Isso por ser uma das fases mais importantes para a dinâmica e regeneração da comunidade e, também, por depender de outros agentes para que o processo ocorra. Assim, a partir do processo de dispersão é possível compreender como uma comunidade se estrutura e se mantém, gerando conhecimentos que embasam estudos voltados para regeneração e restauração florestal. No meu estudo, busco entender como a limitação de dispersão possibilita a coexistência das espécies em uma comunidade vegetal.
A partir de um fragmento vegetal característico da transição restinga-encosta, com manchas de Floresta Paludosa, pretendo investigar a coexistência de 120 espécies arbóreas existentes nessa comunidade. Minha hipótese é que a coexistência dessas espécies se relaciona com as diferenças de limitação de dispersão entre as espécies. Para testar essa hipótese vou identificar as sementes que estão chegando ao solo e verificar a distribuição da limitação de dispersão entre as 120 espécies da comunidade. O esperado é que a distribuição seja bastante homogênea, indicando a existência de espécies com diferentes capacidades de dispersão. Outras informações importantes para corroborar essa hipótese são as diversidades alfa, medidas em cada um dos coletores amostrados no fragmento e as diversidades beta e gama da comunidade. Espero encontrar pequenos valores de diversidade em cada coletor, devido ao processo determinístico local de chegada de sementes, e valores maiores de diversidade entre os coletores, por conta do processo estocástico de chegada de sementes em diferentes pontos ao longo da comunidade. Logicamente, espero encontrar também uma diversidade regional maior que abranja toda a comunidade. Esses resultados relacionam a capacidade de dispersão e o balanço entre diversidade alfa e beta com a coexistência das espécies.
A importância do processo de dispersão costuma ser reconhecida em grandes escalas espaciais, porém esse processo também é fundamental em escalas menores. Mesmo em apenas um fragmento florestal pode-se identificar diversas unidades espaciais que podem estar conectadas através do processo de dispersão. Além disso, cada uma dessas unidades espaciais pode ser fonte de sementes com a mesma capacidade de dispersão que se difere significativamente de outras unidades. Assim, uma comunidade bem estruturada consegue se manter estável através do processo de dispersão diferenciado entre as espécies.
Referências bibliográficas
HURTT, G. C. & PACALA, S. W. 1995. The consequences of recruitment limitation: reconciling chance, history and competitive differences between plants. Journal of Theoretical Biology, 176: 1-12.
LEIBOLD, M. A. 2009. Spatial and metacommunity dynamics in biodiversity. In: “The Princeton guide to ecology”, Simon A. Levin. Princeton University Press, p. 312-319.
LOREAU, M. 2000. Are communities saturated? On the relationship between alfa, beta and gama diversity. Ecology Letters, 3: 73-76.
MACARTHUR, R. M. & WILSON, E. O. 1967. The theory of island biogeography. Princeton University Press.
MULLER-LANDAU, H. C. et al. 2002. Assessing recruitment limitation: concepts, methods and case-studies from a tropical forest. In: “Seed dispersal”, Levey, pp. 35-53.
PACALA, S. W. & LEVIN, S. A. 1997. Biologically generated spacial pattern and the coexistence of competing species. In: “Spacial ecology: the role of space in population dynamics and interspecific interactions.”, Tilman, D. & Kareiva, P. Princeton University Press, pp. 204-232.
RICKLEFTS R. E. 1987. Community diversity: relative roles of local and regional processes. Science, New Series, 235(4785): 167-171.
VELLEND, M. 2010. Conceptual synthesis in community ecology. The quarterly review of biology, 85(2): 183-206.
WHITTAKER, R. H. 1972. Evolution and measurement of species diversity. Taxon, 21(2/3): 213-251.
Nicho, competição e estrutura da comunidade
Myldred Ometto Spinelli
O conceito de nicho ecológico foi proposto primeiramente por Johnson, entretanto foi pouco utilizado até que Grinnell (1917) retomou o termo e o tornou amplamente conhecido. Ele o definiu nicho como o “local” da espécie na comunidade ecológica, levando a ideia de que se uma espécie não ocorre em determinada área, o nicho que seria ocupado por ela estaria vazio. Em 1957, Hutchinson apresentou uma nova definição de nicho, definindo-o como a amplitude de condições ambientais que permitem a persistência de uma população em um determinado local, ou seja, a população apresenta um crescimento populacional acima ou igual a zero. Desta forma, ele é um hipervolume n-dimensional, onde as condições ambientais podem ser consideradas abióticas (temperatura, umidade, por exemplo) e bióticas (interações entre as espécies) (Schoener, 2009).
Em comunidades naturais, as espécies não ocorrem isoladamente, desta forma, Hutchinson definiu como nicho fundamental o nicho que a população ocuparia na ausência de outras espécies e nicho realizado a porção do nicho fundamental ocupado pela população na presença de outras espécies que competem com estas por recursos (Schoener, 2009). Este conceito é chave na ecologia de comunidades, pois cabe a ela entender quais características das espécies permitem à elas manterem-se no espaço e no tempo (Giacomini, 2007), além disto, em qualquer comunidade, existem espécies coexistindo, implicando uma sobreposição espaço-temporal na distribuição de algumas espécie (Giacomini, 2007).
A quantificação de nicho pode ser expressa por uma noção de amplitude e sobreposição, onde as espécies dentro de uma comunidade partilham os recursos disponíveis entre si. Este fator é determinante da diversidade das espécies que coexistentes (Pianka, 1974). MacArthur e Levins propuseram que não pode haver uma grande sobreposição de nicho para que as espécies possam coexistir, pois se assim for, o competidor superior irá levar o outro a extinção local. O grau máximo em que duas espécies podem ser semelhantes e coexistirem é chamado de similaridade limitante (sobreposição de nicho mediana) (Schoener, 2009). Desta forma, as relações tróficas estão entre as mais importantes na organização das comunidades ecológicas (Rocha, 1994; Pianka & Vitt, 2003). Sendo assim, a determinação da dieta é uma atividade que envolve aspectos relacionados à história evolutiva, tamanho corpóreo, especialização relacionada ao habitat e disponibilidade de alimento (Pianka & Vitt, 2003).
O objetivo do meu trabalho é avaliar o uso do espaço e a dieta de três espécies de felídeos de pequeno porte (Leopardus tigrinus, Leopardus wiedii e Puma yagouaroundi) em uma área de silvicultura de eucalipto. A presença de uma espécie significa que a área abriga as condições necessárias para sua presença na área. Desta forma, através da análise da dieta e uso do espaço será possível identificar algumas dimensões dos nichos ocupados por estas espécies simpátricas em uma paisagem antropizada.
O meu estudo pretende compreender como é o uso do espaço por felídeos de pequeno porte em uma paisagem composta por uma matriz de eucalipto, pastos abandonados e vegetação nativa constituída de Cerrado e Mata Atlântica. Para isto, será analisada a área de vida, uso do habitat, padrão de movimentação, padrão temporal de atividades e dieta. Desta forma, será possível definir diversas dimensões que permitem às espécies estarem presentes na área (amplitude de nicho), assim como a sobreposição de nicho destas populações, compreendendo como partilham os recursos existentes de forma a coexistiram no espaço e no tempo.
Referências bibliográficas
Giacomini, H. C. Os mecanismos de coexistência de espécies como vistos pela teoria ecológica. Oecol. Bras., 11 (4): 521-543, 2007.
Grinnell, J. The niche relationships of the California thrasher. Auk 34: 427-433, 1917.
Hutchinson, G.E. Concluding remarks. Cold spring harbor symposia on quantitative biology 22: 415-427, 1957.
MacArthur, R.H. e Levins, R. The limiting similarity, convergence and divergence of coexisting species. American Naturalist 101: 377-385, 1967.
Pianka, E.R. Niche overlap and diffuse competition. Proc. Nat. Acad. Sci. USA. 71 (5): 2141-2145, 1974.
Pianka, E.R. e Vitt, L.J. Lizards: windows to the evolution of diversity. London: University of California Press, Ltd, p. 333, 2003.
Rocha, C.F.D. Introdução a ecologia de lagartos brasileiros. In: Nascimento, L.B., Bernardes, A.T. e Cotta, G.A. Herpetologia do Brasil 1, p.p. 134, 1994.
Schoener, T.W. The ecological niche. In: Levin, S.A. (ed). The princeton guide to ecology. Princeton University Press, p. 3-13, 2009.
Espaço e Território
Gabriela de Lima Marin
Dentro do panorama geral da ecologia de comunidades, a territorialidade está diretamente ligada à teoria de nichos e à competição. Existe, inclusive, um nome mais específico de competição para territorialidade em animais: competição por interferência, que descreve os casos nos quais um indivíduo não acaba com o recurso existente, mas impede o acesso de outros indivíduos a este recurso (Begon et al, 2005). Quando a territorialidade é expressa contra indivíduos de outras espécies ela está diretamente dentro do âmbito da Ecologia de Comunidades (interação entre espécies), mas em geral, a territorialidade se manifesta entre indivíduos da mesma espécie (competição intraspecífica). Neste caso, um dos efeitos que a ela pode ter na comunidade é permitir a coexistência de espécies (MacArthur, 1958), já que diminui sua densidade populacional e permite que outra (pior competidora) também ocupe essa região. Como essas relações entre territorialidade e comunidade já são bastante conhecidas, e, além disso, a territorialidade, a meu ver, é um tema essencialmente espacial, optei por associar meu tema de pesquisa à Ecologia Espacial.
As interações entre espécies e também a diversidade local de espécies foi inicialmente explicada no início do século XX, em Ecologia de Comunidades, através de modelos determinísticos, que são equações diferenciais ordinais (EDOs;) (ex. competição, predação Lotka-Volterra, facilitação) que descrevem a dinâmica populacional de 1 ou mais espécies. Desde então, diversos avanços conceituais e analíticos foram alcançados. Um dos principais foi a inclusão do espaço como explicação para os padrões observados. Esta inclusão não aconteceu por acaso: acumulou-se consideráveis evidências de que o espaço afeta a dinâmica das populações e a estrutura da comunidade (Cantrell & Cosner, 2003) e em muitos casos, esses modelos que consideravam os fatores habitualmente tratados em ecologia não eram capazes de explicar os padrões observados (Cantrell & Cosner, 2003). O modelo de competição, por exemplo, previa que somente uma das espécies competidoras deveria permanecer no local caso ambas dependessem de um único recurso (Lotka, 1925; Volterra, 1928), no entanto, observa-se grande diversidade de organismos em ambientes com pouca variedade de recursos (ex. pradarias ou lagos) (Tilman & Kareiva, 1997), problema conhecido como Paradoxo de Hutchinson. Considerar a heterogeneidade do ambiente e a possibilidade de dispersão (aspectos espaciais do ambiente) permitiu explicar essa grande diversidade (Tilman & Kareiva, 1997).
A área da Ecologia que se propôs a estudar a influência do espaço é justamente a Ecologia Espacial e algumas de suas principais áreas de estudo são: estabilidade da comunidade, padrões de diversidade, invasões biológicas, coexistência e geração de padrões espaciais (Tilman & Kareiva, 1997). Modelos espaciais são aqueles que consideram a estrutura espacial do ambiente (Tilman & Kareiva, 1997) de maneira implícita ou explicita. Nos modelos espacialmente implícitos, podem ser incluídos parâmetros que são correlacionados com a escala espacial (ex. distância do continente na biogeografia de ilhas) ou então podem descrever que uma fração do ambiente está ocupada por uma espécie sem especificar qual é o arranjo espacial dessa fração (ex. porcentagem de manchas ocupadas no modelo de Metapopulações) (Cantrell & Cosner, 2003). Ou seja, a importância do espaço é reconhecida, mas os parâmetros de interesse não são localizados no espaço (taxas de colonização/extinção na Biogeografia e % manchas ocupadas na Metapopulações). Já os modelos espacialmente explícitos são aqueles em que cada indivíduo possui uma posição determinada por um sistema de coordenadas e os pontos diferentes podem ter características diferentes (Tilman & Kareiva, 1997) ou então, aquele que a variável analisada depende diretamente do espaço (Zavala et al, 2006).
Atualmente existem diversos tipos de modelos espacialmente explícitos (ex. equação de reação-difusão, celullar automata, sistema de partículas interativas, modelos baseados em indivíduo, equação de advecção-difusão) utilizando diversas técnicas analíticas. Eles variam no grau de detalhamento espacial (macroscópico, intermediário, microscópico) e na generalidade que podem alcançar (Díaz-Sierra & Zavala, 2008). Uma dessas técnicas analíticas, que pode ser usada para detalhamento intermediário e microscópico, são as Equações Diferenciais Parciais (EDP). Essa é uma das principais ferramentas matemáticas para analisar processos espaço-temporais (Holmes et al, 1994). Comparando com as equações antes utilizadas para os modelos (EDOs), elas são matematicamente mais complicadas, mas são mais realistas (podem alcançar nível de detalhe microscópico) e têm a vantagem de possibilitar ao modelador incorporar processos temporais e espaciais ao mesmo tempo em equações que governam a dinâmica populacional (Holmes et al, 1994). Basicamente, elas modelam o fenômeno de difusão (Díaz-Sierra & Zavala, 2008) e podem ser usadas para descrever o movimento das espécies, populações ou indivíduo como difusão (Tilman & Kareiva, 1997; Skellam, 1951).
Uma das possibilidades de aplicação dessa ferramenta foi introduzida por Skellam (1951). Ele fez a ligação entre a caminhada aleatória como descritor do movimento individual e a equação de difusão dos gases como descritor da dispersão no nível da espécie. Além disso, juntou a descrição da dispersão através da difusão com a dinâmica populacional (crescimento exponencial e logístico) para explicar a invasão biológica de um roedor na Europa. Ele fez isso através de um tipo especial de equação diferencial parcial, as equações de reação-difusão (Cantrell & Cosner, 2003). Para a ecologia, o termo da equação que representa a “reação” inclui os processos populacionais e as interações com outras espécies (ex. expressão do crescimento logístico) e o termo “difusão” descreve o movimento dos indivíduos ou população (geralmente corresponde ao processo de difusão passiva) (Tilman & Kareiva, 1997). Além do objetivo proposto por Skellam (1951), essa ferramenta foi utilizada para explicar outros processos ecológicos como dispersão, coexistência entre espécies e formação de padrões espaciais estáveis (Okubo, 1980; Azevedo, 2013).
Outro tipo de EDP utilizada em estudos de ecologia espacial é a equação de advecção-difusão. Esse tipo de equação é utilizado principalmente na área de seleção de habitat (Grünbaum, 1998). Nesse caso, difusão descreve o movimento individual (a probabilidade de movimento do indivíduo) e o termo advecção introduz um viés na difusão (probabilidades diferente para cada direção/sentido do movimento) (Lewin et al, 2005; Moorcroft et al, 1999); ele direciona o movimento (Azevedo, 2013). Na ecologia, esse viés pode representar a fidelidade de sítio (a memória do indivíduo) ou também, como já foi utilizado em estudos sobre fragmentação, para descrever o animal que atravessa a matriz de um fragmento para outro. Esse viés é adicionado pois, como a matriz é um ambiente hostil, o indivíduo deve atravessar o mais reto possível esse ambiente. O efeito desse viés foi favorecer a permanência da espécie na paisagem e em fragmentos pequenos (Azevedo, 2013). As informações inseridas nas equações são médias provenientes de estudos de campo e eslas irão descrever um estado estável de arranjo espacial (Potts & Lewis, 2014). Um aspecto interessante sobre esses modelos é que, por determinar o padrão espacial através do movimento individual, ele descreve um possível processo pelo qual o padrão se forma (Tilman & Kareiva, 1997).
Em meu mestrado, irei descrever como o tamanho e a sobreposição da área de vida variam em função de alguns fatores ambientais e individuais em conjunto para três espécies de roedores da Mata Atlântica. Portanto, meu mestrado é essencialmente descritivo e não é espacialmente explícito, pois eu não preciso saber onde estão os indivíduos. Tomando contato com as EDPs, que permitem incluir difusão em estudos populacionais e descrever movimentos individuais com a possibilidade de determinar direções preferenciais, decidi estudar se e, em caso afirmativo, como essas ferramentas poderiam ser utilizadas no estudo da territorialidade, i.e. como seria o estudo da territorialidade espacialmente explicito. De fato, já existem trabalhos que abordam territorialidade dessa forma: Lewis & Murray (1993) propuseram o uso das equações de advecção-difusão para determinar a formação de territórios de lobos em uma dimensão. O termo de advecção traduz, nesse caso, a seguinte informação: lobos evitam áreas que contém marcação odorífera de outros indivíduos e vão para o centro da área de vida; e o termo de difusão representa o movimento dos indivíduos para um lado ou para outro. Com esse mecanismo simples, alguns trabalhos foram capazes de chegar em padrões de territórios em duas dimensões, com baixa sobreposição e com algumas regiões sem indivíduos dessa espécie (regiões entre marcação de 2 indivíduos) que serviram como refúgio para as presas da espécie (Moorcroft, 1999; Potts et al, 2014). Esses padrões foram encontrados independente de heterogeneidade espacial (mais ou menos recurso) e mesmo assim foram capazes de explicar grande parte da distribuição espacial de 2 espécies da comunidade (lobo e veado) no parque de Yellowstone (Moorcroft, 1999; Potts et al, 2014).
Por mais que seja muito interessante que praticamente uma fórmula matemática seja capaz de gerar um padrão observado em campo, é importante lembrar que esse modelo depende de uma informação obtida provavelmente em estudos descritivos de população e comunidade: que lobos se alimentem de veados e que eles evitam regiões com marcação de outros lobos. Assim, estudos descritivos ainda são úteis (não adianta chegar a um padrão que não se sabe se é observado na natureza). O mais interessante seria ter os dois estudos (descritivo e mecanístico) relacionados (Werner, 1998). No meu caso, não só descrever territórios, mas também avaliar os mecanismos que geram territórios nesses roedores.
Para os dois tipos de EDP já houveram avanços além dos descritos aqui. Alguns exemplos são (1) inclusão da possibilidade de territórios mudarem de lugar ao longo do tempo e não mais serem tratados como padrões estáveis (Bateman et al, 2014) como era apontado como falha desse tipo de abordagem (Tilman & Kareiva, 1997); (2) junção dos dois tipos de equação para descrever a persistência de populações em sistemas fragmentados (equações de reação-difusão-advecção) (Azevedo, 2013) ou (3) a persistência de populações/comunidades de microrganismos no alto de um rio (seria esperado que os indivíduos fossem levados até a foz pela correnteza).De uma forma geral, pode-se perceber que a inclusão do espaço como variável explicativa aumenta bastante o poder de explicação das dinâmicas dentro da Comunidade e de padrões observados nas populações. Para os dois casos, ela permite descrever processos que podem gerar o padrão observado. Estudar um fenômeno natural tanto por padrão quanto pelos processos que podem gerar esse padrão é bastante importante atualmente e a combinação das duas frentes dentro de um projeto/programa de pesquisa é bastante desejada (Werner, 1998). Sobre as EDP, embora existam outros tipos de modelos espacialmente explícitos que possibilitam análises mais detalhadas, por ser possível incluir a média populacional e possibilitar tratar espaço e tempo como contínuos, elas ainda são e serão muito úteis.
Referências Bibliográficas:
Azevedo, F. S. D. (2013). Sistemas ecológicos modelados por equações de reação-difusão. (Doutorado). Instituto de Física Teórica, Universidade Estadual Paulista, 71p.
Bateman, A. W., Lewis, M. A., Gall, G., Manser, M. B. & Clutton-Brock, T. H. (2014). Territoriality and home-range dynamics in meerkats Suricata suricatta. Journal of Animal Ecology, doi: 10.1111/1365-2656.12267
Begon, M., Townsend, C. R., J. L. (2005). Ecology: From Individuals to Ecosystems. 4th Edition Wiley-Blackwell, 752pp.
Cantrell, R. S., & Cosner, C. (2003). Spatial ecology via reaction-diffusion equations. Chichester, West Sussex, England: J. Wiley.
Díaz-Sierra, R. & Zavala, M. A. (2008). Modelos Espacialmente Explicito, pp. 371-409. Em: Introducción al análisis espacial de datos en ecología y ciencias ambientales: métodos y aplicaciones. F. T. Maestre, A. Escudero & A. Bonet (editores). Universidad Rey Juan Carlos.
Grünbaum, D. (1998). Using Spatially Explicit Models to Characterize Foraging Performance in Heterogeneous Landscapes. The American Naturalist, 151(2): 97-113.
Holmes, E. E., Lewis, M. A., Banks J. E. & Veit, R. R. (1994). Partial Differential Equations in Ecology: Spatial Interactions and Population Dynamics. Ecology, 75(1): 17-29.
Lewis, M. A. & Murray, J. D. (1993). Modelling territoriality and wolf–deer interactions. Nature, 366: 738–740. (doi:10.1038/366738a0)
Lewis, M. A., Hillen, T., & Lutscher, F. (2005). Spatial dynamics in ecology. IAS/Park City Math. Series, 15: 3–21.
Lotka, A. J. (1925). Elements of Physical Biology. Williams and Wikins
MacArthur, R. H. (1958). Population ecology of some warblers of northeastern coniferous forests. Ecology, 39(4): 599-619.
Moorcroft , P. R., Lewis, M. A., Crabtree, R. L. (1999). Home range analysis using a mechanistic home range model. Ecology. 80: 1656–1665. (doi:10.1890/0012-9658(1999)080[1656:HRAUAM]2.0.CO;2)
Okubo, A. (1980) Diffusion and Ecological Problems: Mathematical Models. (Biomathematics, Vol. 10.) Springer-Verlag, Berlin-Heidelberg-New York, 254 pp.
Potts, J. R., Lewis, M. A. (2014). How do Animals territories form and change? Lessons from 20 years of mechanistic modelling. J. R. Soc. Interface 11: 20140333
Skellam, J. G. (1951). Random Dispersal in Theoretical Population. Biometrika, 38 (1-2): 196-218. doi:10.1093/biomet/38.1-2.196
Tilman, D. & . Kareiva, P. (1997). Spatial Ecology: the Role of Spare in Population Dynamics and Interspecies Interactions. Princeton University Press, Princeton, NJ 365p.
Volterra, V. (1928). Variation and Fluctuation of the Number of Individuals in Animal Species Living Together. J. Cons. Cons. Int. Expor. Mer 3: 3-51
Werner, E. E. (1998). Ecological experiments and a research program in community ecology. pp 3-27 Em: Resetarits B. & J. Bernardo. Experimental ecology: issues and perspectives. Oxford University Press.
Zavala, M. A., Díaz-Sierra, R., Purves, D., Zea G. E. & Urbieta, I. R. (2006). Modelos Espacialmente Explícitos. Ecosistemas, 15 (3): 88-99.
Florestas Tropicais e áreas degradadas – Estados Alternativos de Equilíbrio Estável
Bruno Sano
As comunidades e ecossistemas podem ser considerados sistemas dinâmicos, uma vez que seu estado pode ser entendido como o resultado do balanço de inúmeros processos (Scheffer 2009). Quando estes sistemas possuem o potencial de existir indefinidamente em estados contrastantes sobre as mesmas condições ambientais, pode-se dizer que o sistema possui Estados Alternativos de Equilíbrio Estável (Schöder et al., 2005). Os sistemas que se encontram em um estado de equilíbrio estável apresentam alta resiliência, ou seja, após um pequeno distúrbio ele retorna ao seu estado de equilíbrio. Isso ocorre porque existem forças (ex. Feedback negativo e positivo) que atuam fazendo com que o sistema retorne ao seu estado original. Até certo tempo atrás se acreditava que os sistemas, quando perturbados, respondiam de forma linear, previsível e controlável (Folke et al., 2002), porém, alguns trabalhos (Blindow et al., 1993; Persson et al., 2007) têm demonstrado que na natureza existem também mudanças bruscas de estado. Essas mudanças abruptas ocorrem quando a condição ambiental muda o suficiente para ultrapassar o limiar crítico da condição, o “ponto de bifurcação”, fazendo com que o sistema mude de um estado estável para outro estado estável. Uma vez que o sistema entra neste novo estado de equilíbrio, ele tende a ficar nele até que a condição ambiental mude o suficiente para encontrar outro ponto de bifurcação e ocorra uma mudança abrupta para um estado de equilíbrio diferente (Scheffer 2009).
Pequenas mudanças nas condições ambientais nem sempre são refletidas em mudanças perceptíveis no sistema, porém podem diminuir a resiliência da mesma (Scheffer 2009). Sistemas com baixa resiliência são mais sensíveis às mudanças das condições ambientais, fazendo com que pequenas perturbações levem o sistema a outro estado de equilíbrio (Scheffer et al., 2001). Visto que as comunidades ecológicas estão constantemente sujeitas a perturbações como atividades antrópicas e fenômenos climáticos, entender as consequências das perturbações sobre as comunidades e quais os pontos de bifurcação são fundamentais para tentar prever uma mudança de estado, assim como manejar sistemas que se encontram em um estado de equilíbrio “não desejável” (ex: áreas degradadas).
Estados alternativos foram observados em diferentes sistemas biológicos como recifes de coral (Knowlton 1992), desertos (deMenocal et al., 2000) e florestas (Hirota et al., 2011). As Florestas Tropicais e as áreas degradadas podem ser consideradas estados alternativos de equilíbrio estável de um mesmo sistema. As áreas degradadas com predominância de gramíneas impede que novos indivíduos consigam se estabelecer devido à alta radiação solar e temperatura, e competição com as gramíneas por recursos. Por outro lado, as florestas conseguem manter a umidade local, diminuem a incidência de radiação solar e temperatura no interior das mesmas, permitindo que novos indivíduos cheguem e se estabeleçam, e com isso, o sistema se mantem autossustentável. Evidencias indicam que a facilitação pode ser um dos mecanismos de feedback positivo responsável por mudar o sistema de um estado degradado para um de floresta (Bruno et al., 2003; Holmgren & Scheffer, 2001).
A facilitação pode ser definida como uma interação positiva entre espécies, na qual a presença de uma espécie afeta direta ou indiretamente o crescimento e sobrevivência da outra espécie (Callaway 1997). Nesse contexto, a presença de um indivíduo adulto em uma área degradada pode amenizar as condições ambientais extremas encontradas nestes locais, e facilitar o estabelecimento de outros indivíduos, podendo ser um “gatilho” para a reestruturação da comunidade.
O meu projeto de mestrado está inserido em um projeto maior que busca entender o balanço de interações positivas (facilitação) e negativas (competição) entre espécies vegetais de diferentes grupos ecológicos, com agregações espaciais diferentes (isoladas e agregadas), em áreas degradadas. Esse projeto, assim como outros projetos de restauração, pode fornecer informações de quão resiliente são as áreas degradas, e qual é o ponto de bifurcação em que o sistema passa de um estado de área degrada para um de floresta, em que os processos ecológicos são restabelecidos. Isso faz com que o sistema volte a ser autossustentável e não precise mais de forças externas (ex: manejo) para seguir a sucessão.
Além disso, busco entender quais atributos funcionais de resposta das plantas estão relacionados ao estado de área degradada, particularmente os estágios iniciais de sucessão. Atributos funcionais de resposta são características mofo- fisio-fenológica que variam em resposta a variações ambientais, e podem dar um indicativo de como as espécies se comportam frente às condições ambientais a que estão expostas (Violle et al., 2007). Visto que um dos principais gargalos de projetos de restauração é o alto custo do plantio e manutenção, utilizar as informações de quais espécies possuem características que as possibilitam ocupar determinado ambiente, diminui os prejuízos causados pela mortalidade das plantas e aumenta a chance do sistema seguir a dinâmica sucessional. Além disso, é possível que ao identificar quais atributos funcionais estão relacionados com os estágios iniciais de sucessão, facilite o alcance do ponto de bifurcação para que o sistema mude de estado de equilíbrio estável.
Referências bibliográficas
Blindow I. et al. 1993. Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology 30: 159-167
Bruno, J.F., Stachowicz, J.J. & Bertness, M.D. (2003). Inclusion of facilitation into ecological theory. Trends Ecol. Evol., 18, 119–125.
Callaway, R.M. (1997). Positive interaction in plant communities and the individualistic continuum concept. Oecologia 112: 143-149.
DeMenocal, P.; Ortiz, J.; Guilderson, T.; Adkins, J.; Sarnthein, M.; L. Baker & M. Yarusinsky. 2000. Abrupt onset and termination of the African Humid Period: rapid climate responses to gradual insolation forcing. Quaternary Science Reviews, 19:347-361.
Folke, C.; Carpenter, S.; Elmqvist, T.; Gunderson, L.; C.S. Holling & B. Walker. 2002. Resilience and Sustainable Development: Building Adaptive Capacity in a World of Transformations. Ambio, 31:437-440.
Hirota et al. 2011. Global resilience of tropical forest and savanna to critical transitions. Science 334: 232-235.
Holling C.S. 1973. Resilience and stability of ecological systems. Annu. Rev. Ecol. Syst. 4: 1-23.
Holmgren, M. & Scheffer, M. 2001. El Niño as a window of opportunity for the restoration of degraded arid ecosystems. Ecosystems 4 (2), 151-159
Knowlton N. 1992. Thresholds and multiple stable states in coral reef community dynamics. Am Zool 32:674-82.
Persson et al. 2007. Culling prey promotes predator recovery - alternative states in a whole-lake experiment. Science 316: 1743-1746.
Scheffer, M. et al. 2001. Catastrophic shifts in ecosystems. Nature 413: 591-596.
Scheffer, M. 2009. Alternative Stable States. In: Critical Transitions in Nature and Society, Chapter II, pp. 11-36, Princenton University Press.
Schröder, A.; Persson, L.; De Roos, A. M. (2005). “Direct experimental evidence for alternative stable states: a review”. Oikos 110 (1): 3–19.
Violle, C., Navas, M.L., Vile, D., Kazakou, E., Fortunel, C., Hummel, I., Garnier, E. 2007. Let the concept of trait be functional!. Oikos, v. 116, p. 882–892.
Teoria de Biogeografia de Ilhas e sua influência na Ecologia de Paisagem
Camila Celestino Hohlenwerger
Compreender como padrões de diversidade são gerados é uma das grandes perguntas gerais da Ecologia (Sutherland et al., 2013). Na década de 60, enquanto a maioria dos padrões de diversidade eram explicados por teoria de nicho, ou por processos de competição ou predação (Klopfer & MacArthur, 1961), a Teoria de Biogeografia de Ilhas proposta por Robert MacArthur e Edward Wilson (1967) surge trazendo consigo uma nova abordagem na qual a interação entre as espécies tem papel menos fundamental na explicação de padrões de diversidade em ambientes insulares (Gotelli, 2009). A Teoria de Biogeografia de Ilhas prevê que o número de espécies em uma ilha está positivamente relacionado ao tamanho da ilha, e que a distância da ilha até a área fonte de espécies mais próxima está inversamente relacionada ao número de espécies (MacArthur & Wilson 1967). Ao alcançar a saturação de espécies da ilha, é instalado um estado de equilíbrio dinâmico, no qual o número de espécies é mantido apesar de a composição de espécies não se manter a mesma. Esse estado de equilíbrio é alcançado através de um balanço entre as taxas de imigração e extinção (Gotelli, 2009).
A Teoria de Biogeografia de Ilhas é considerada um marco na Ecologia (Begon et al., 2006; Losos & Ricklefs 2010). Além de ressaltar a importância e o potencial que o estudo de ilhas tem para compreensão de padrões biológicos (Losos & Ricklefs 2010), a Teoria se sobressai por apresentar de modo simples como, através de um balanço entre imigração (na qual a distância até a área fonte é o principal fator de influência) e extinção (na qual a área da ilha é o principal fator de influência) é possível se alcançar um equilíbrio dinâmico sem levar em consideração interação entre as espécies (Gotelli, 2009). Nesse contexto, uma das suposições desse modelo de equilíbrio é de que a presença de uma espécie não altera a chance de colonização ou de extinção de outra espécie (Gotelli, 2009).
A relação espécie-área é considerada uma das poucas leis em Ecologia (Gotelli, 2009), e apesar de ter sido proposta como um modelo que explica o padrão de diversidade de ambientes insulares, seu modelo foi extrapolado no estudo de outros ambientes isolados (MacArthur & Wilson 1967, Gotelli 2009; Losos & Ricklefs 2010). Posteriormente, essa relação espécie-área no modelo de equilíbrio biogeográfico de ilhas passou a ser utilizada também em ambientes terrestres em situação similares a ambientes isolados, como no caso de fragmentos florestais (Metzger, 2001; Losos & Ricklefs 2010). Assim, a Teoria de Biogeografia de ilhas se tornou um dos principais paradigmas norteadores da construção de conhecimentos em Ecologia de Paisagens (Ricketts, 2001). A relação espécie-área trouxe avanços importantes em debates sobre a proteção e escolha de áreas de reserva naturais (Higgs & Usher 1980), onde os fragmentos florestais eram vistos como análogos às ilhas (áreas isoladas) e a matriz como o oceano (ambiente inóspito) (Fahring, 1998; 2003). Desse modo, quanto maiores os fragmentos, maior a quantidade de habitats que este possui e, portanto, maior o número de espécies que este suporta. No entanto, quanto mais isolados os fragmentos, menor a taxa de chegada de espécies. Nesse caso, os fatores limitantes seriam os mesmos propostos pela relação espécie-área no modelo de equilíbrio biogeográfico de ilhas: extinção (área) e imigração (grau de isolamento, distância até a fonte de espécies mais próxima) (Doak et al. 1992; Gotelli, 2009).
No entanto, posteriormente, a comunidade científica percebeu que não era razoável assumir que matrizes seriam locais inóspitos e, portanto, configurariam isolamento completo aos fragmentos florestais (Ricketts, 2001; Ewers & Didham, 2006; Prevedello & Vieira, 2010). A matriz não deve ser considerada homogênea, mas sim como um mosaico de habitats intermediários ou menos favoráveis à determinadas espécies encontradas nos fragmentos (Ricketts, 2001; Fischer et al., 2005; Prevedello & Vieira, 2010). Matrizes podem inclusive ser manejadas de modo que o seu valor como habitats intermediários seja elevado, permitindo assim que esta seja utilizada por organismos tanto para movimentação entre fragmentos como fonte de recurso alimentar (Vandermeer & Carvajal 2001; Fischer et al., 2005).
Apesar da negação do pressuposto de que o isolamento de fragmentos florestais seria análogo ao isolamento de ilhas, a Teoria de Biogeografia de Ilhas foi e é fundamental na construção de conhecimentos em Ecologia de Paisagem. A meu ver, a maioria do conhecimento acumulado em Ecologia de Paisagem sobre fragmentação, perda de habitat, restauração e mais recentemente, sobre como a matriz influencia nas questões anteriores se deve muito ao trabalho de Robert MacArthur e Edward Wilson (1967), e a sua repercussão na comunidade científica. Mais recentemente, estudiosos da Ecologia de Paisagens tentam compreender como diferentes tipos de matriz, com permeabilidades e características físicas e biológicas distintas influenciam na diversidade de espécies em paisagens fragmentadas, acessando assim qual o grau efetivo de isolamento desses fragmentos (Ricketts, 2001; Murphy and Lovett-Doust, 2004; Ewers & Didham, 2006). A ideia central é tentar compreender como a variação no tipo de matriz influencia os padrões de diversidade, e incorporar esses parâmetros aos modelos já bem estabelecidos que considerem abordagens como de Teoria de Biogeografia de Ilhas (Ricketts, 2001). A incorporação desses parâmetros de resistência da matriz à Teoria de Biogeografia de Ilhas geram predições testáveis importantes (ex: em matrizes resistentes, ou seja, pouco permeáveis para as espécies, espera-se uma redução na riqueza de espécies em fragmentos isolados), e alternativas de manejo que visem a redução do grau de isolamento efetivo de fragmentos (ex: redução da resistência da matriz facilitando a conectividade entre fragmentos, corredores e step stones) (Simberloff et al. 1992; Ricketts 2001).
Tenho interesse em compreender como a perda de habitat na escala da paisagem influencia na diversidade, e mais especificamente, como as alterações nessa diversidade influenciam processos ecológicos desempenhados por essas espécies na matriz. Meu projeto de mestrado tenta compreender como que a redução de habitat na paisagem irá influenciar o processo de predação em interfaces de habitat e matriz de pasto. A ideia central é entender como a variação na quantidade de habitat na paisagem influencia processos que estão sendo desenvolvidos na matriz, como no caso, predação de invertebrados em pastos. Entender como que esses processos estão ocorrendo na matriz, e como isso se relaciona com a diversidade de espécies ao longo variação de quantidade de habitat é fundamental para medidas que envolvam prestação de serviços ecossistêmicos por fauna nativa como mecanismo para manutenção de habitat nativo em paisagens antropizadas (Millennium Ecosystem Assessment, 2005).
Referências bibliográficas
Begon, M.; Townsend, C.R. & Harper, J.L. 2006. Ecologia: de indivíduos a ecossistemas. 4. ed. – Porto Alegre: Artmed, 2007.
Doak, D. F., P. C. Marino, P. M. Kareiva. 1992. Spatial scale mediates the influence of habitat fragmentation on dispersal success: implications for conservation. Theoretical Population Biology 41:315–336.
Ewers, R. M. & Didham, R. K. 2006. Confounding factors in the detection of species response to habitat fragmentation. Biological Reviews 81(1): 117-142.
Fahrig, L. 1998. When does fragmentation of breeding habitat affect population survival? Ecological Modelling 105 (2-3): 273-292.
Fahrig, L. (2003). “Effects of habitat fragmentation on biodiversity”. Annual Review of Ecology Evolution and Systematics 34: 487-515.
Fischer, F., Fazey, I., Briese, R., D. B. Lindenmayer. 2005. Making the matrix matter: challenges in Australian grazing landscapes. Biodiversity and Conservation 14(3): 561-578.
Gotelli, N. J. 2009. Ecologia. 4 edição. Editora Planta.
Higgs, A. J., Usher, M. B. 1980. Should nature reserves be large or small? Nature. 285: 568-569.
Klopfer, P. H., MacArthur, R. H. 1961. On the causes of species diversity: Niche overlap. The American Naturalist. 95.
Losos, J. e Ricklefs, R. (Eds.). 2010. The Theory of Island Biogeography Revisited. Princenton University Press.
MacArthur, R. H., Wilson, E. O. 1967. The theory of island Biogeography. The Princeton University.
MacArthur, R. H. 1958. Population ecology of some warblers of northeastern coniferous forests. Ecology, 39(4): 599-619.
Metzger, J.P. 2001. “O que é ecologia de paisagens?”. Biota Neotropica. http://www.biotaneotropica.org.br/v1n12/pt/abstract?thematic-review+BN00701122001 (último acesso 14.01.2015)
Millennium Ecosystem Assessment. 2005. Ecosystems and Human Well-being: Biodiversity Synthesis (World Resources Institute, 2005).
Murphy, H. T. & Lovett-Doust. 2004. Context and connectivity in plant metapopulations and landscape mosaics: does the matrix matter? Oikos 105(1): 3-14.
Prevedello, J. A. & Vieira, M. V. 2010. Does the type of matrix matter? A quantitative review of the evidence. Biodiversity and Conservation 19(5): 1205-1223.
Ricketts, T. H. 2001. The Matrix Matters: Effective Isolation in Fragmented Landscapes. The American Naturalist 158(1): 87-99.
Simberloff, D., J. A. Farr, J. Cox, D. W. Mehlman. 1992. Movement corridors: conservation bargains or poor investments? Conservation Biology 6:493–504. Sutherland, W. J., Freckleton, R., Godfray, H. C. J., Beissinger, S. R., Benton, T., Cameron, D. D., Carmel, Y., Coomes, D. A., Coulson, T., Emmerson, M. C., Hails, R. S., Hays, G. C., Hodgson, D. J., Hutchings, M. J., Johnson, D., Jones, J. P.G., Keeling, M. P., Kokko, H., Kunin, W. E., Lambin, X. E., Lewis, O.T., Malhi, Y., Mieszkowska, M., Milner-Gulland, E. J., Norris, K., Phillimore, A. B., Purves, D.W., Reid, J. M., Reuman, D. C., Thompson, K., Travis, J. M. J., Turnbull, L.A., Wardle D. A. and Wiegand, T. 2013. Identification of 100 fundamental ecological questions. Journal of Ecology 101(1): 58–67.
Vandermeer, J., Carvajal, R. 2001. “Metapopulation dynamics and the quality of the matrix.” American Naturalist 158(3): 211-220.
Nicho ecológico e os efeitos da perda de hábitat
Júlia Ferrúa dos Santos
Ao longo da história o termo nicho recebeu diversas definições, sendo aprimorado por diferentes autores. Inicialmente foi definido por Grinnell como os recursos e condições necessárias para a sobrevivência de uma determinada espécie. Anos depois, Elton incluiu ao conceito os impactos que o organismo gera no ambiente. E por fim - na década de 50 - Hutchinson cria uma definição matemática de nicho e traz a competição como fator importante para melhor compreendê-lo. A contribuição da definição de nicho para a teoria ecológica é fundamental e subsidiou boa parte do avanço no conhecimento em ecologia de comunidades, sendo o processo de construção do conceito tão importante quanto o próprio conceito.
A palavra nicho foi utilizada pela primeira vez por Roswell Johnson em seu trabalho publicado em 1910. Nele, Johnson se referia a nicho como um recurso espacial utilizado pelas espécies (Johnson, 1910). Entretanto, foi Joseph Grinnell que pela primeira vez incluiu o termo em um programa de pesquisa, descrevendo o nicho de diversas espécies de aves e mamíferos (Grinnell & Swarth, 1913). Em seus estudos, ele comparou comunidades de diferentes localidades geográficas e percebeu que poderia haver uma equivalência ecológica entre alguns organismos. Além disso, concluiu também que em determinados locais poderia haver nichos vazios Ele listou diversos fatores ambientais que fariam parte do nicho e considerou também as adaptações fisiológicas e comportamentais geradas como respostas a estes fatores. Para Grinnell, o nicho representava as condições e recursos necessários para a existência de uma espécie, estando intimamente ligado à ideia de exclusão competitiva.
Enquanto Grinnell enfatizava os aspectos ambientais em sua definição, Charles Elton (Elton, 1927) criou uma abordagem que considerava também os potenciais impactos dos organismos sobre o ambiente como parte do nicho. Ele criou uma definição de nicho voltada ao papel do organismo no ambiente, gerando assim uma abordagem mais funcional. Nicho não seriam apenas as condições e recursos consumidos por um organismo, mas também como este organismo modifica o ambiente onde está inserido. Elton deu grande importância à ecologia trófica e ao tamanho do corpo das espécies (Leibold, 1995). Ele acreditava que o tamanho do corpo poderia refletir nas exigências ambientais e aspectos ecológicos do organismo (e.g. efeitos na termorregulação, potenciais predadores, escolha de alimentos). Através dos aspectos da ecologia alimentar, Elton poderia agrupar espécies de acordo com que tipo de alimento que consumiam, usando esta informação como forma de compreender os impactos gerados no ambiente.
Em 1957, George E. Hutchinson formaliza a definição de nicho como um atributo da espécie e não do ambiente, matematizando a mesma como um espaço n-dimensional, onde cada dimensão corresponderia a uma condição ou recurso (Schoener, 2009). Uma definição enfocando explicitamente as necessidades da espécie, porém sua discussão quanto à competição possui um apelo mais relacionado com os impactos e papel desempenhado pelos organismos (Leibold, 1995). Em seus estudos, Hutchinson aborda a similaridade de nicho de espécies simpátricas buscando compreender como a competição poderia afetar o nicho, reduzindo a sobreposição. A definição de Hutchinson gerou uma maneira precisa e quantitativa de caracterizar nicho ecológico. Ao contrário do que Grinnel e Elton acreditavam, para ele não há nicho vazio (Schoener, 2009). Foi Hutchinson que criou os termos “nicho fundamental” e “nicho realizado”, definindo como nicho realizado a porção do nicho fundamental que não se sobrepõe com o de outras espécies (Schoener, 2009). Dessa forma, Hutchinson mudou o enfoque do nicho de um atributo do ambiente para um atributo da própria espécie.
Na década de 60, Robert MacArthur e Richard Levis propuseram uma extensão da abordagem de Hutchinson através do conceito de distribuição da utilização do recurso, onde um nicho é definido para uma população específica, sendo equivalente à frequência de utilização de um recurso (Schoener, 2009). Dessa forma, se torna possível quantificar taxas de sobreposição no consumo de determinado recurso. Uma das mais recentes definições para nicho foi proposta por Matthew Leibold e Jonathan Chase em 2003, onde foi retirado da teoria do nicho um enfoque apenas na competição e em interações locais. Leibold e Chase definiram nicho como a soma das respostas de um organismo e seus impactos, citando recursos, predadores e estresses ambientais como fatores importantes na determinação do nicho.
No meu projeto, eu busco compreender o efeito da perda de hábitat no nicho de pequenos mamíferos. Para responder minha pergunta, utilizo aspectos relacionados à ecologia trófica dos animais. Muitos estudos abordam os efeitos da perda de hábitat (e.g. perda de biodiversidade, diminuição de biomassa, extinção de espécies), entretanto tópicos relacionados a alterações dos nichos ocupados pelos organismos são pouco explorados.
A perda de hábitat e a fragmentação de ecossistemas florestais são consideradas umas das principais causas de extinção de espécies. Uma vez que a área disponível de habitat é reduzida, há um aumento de distúrbios como efeitos de borda e perda de conectividade, de forma que o isolamento entre populações é intensificado (Fahrig 2003). A susceptibilidade de diversas espécies à alteração do habitat pode não estar apenas relacionada a questões demográficas, mas também às redes de interações mantidas entre diferentes espécies (Allesina & Bodini 2004).
A disponibilidade de recursos é um dos fatores afetados pela perda de hábitat (Tabarelli et al. 1999; Crist et al. 2006), e esta pode ser uma das causas pelas quais espécies de vertebrados se tornam sensíveis a mudanças no habitat. Ao mesmo tempo, alterações na disponibilidade de recursos pode desencadear uma variação na dieta de espécies de vertebrados (Nour et al. 1998; Abba et al. 2011), e consequentemente afetar funções ecossistêmicas como polinização, predação de sementes e controle de pragas (Pineda et al. 2005, Fleury & Galetti 2006). Os efeitos da perda de habitat sobre a ecologia alimentar é, portanto, um importante ponto a ser compreendido, pois leva a um maior conhecimento sobre o funcionamento do ecossistema (Cagnolo et al. 2009).
Referências Bibliográficas
Abba, F.; Morellet, N.; Hewison, A. J. M.; Merlet, J.; Cargnelutti, B.; Lourtet, B.; Angibault, J. M.; Daufresne, T.; Aulagnier, S.; Verheyden, H. 2011. Landscape fragmentation generates spatial variation of diet composition and quality in a generalist herbivore. Oecologia, 167:401-411.
Allesina, S. & Bodini, A. 2004. Who dominates whom in the ecosystem? Energy flow bottlenecks and cascading extinctions. Journal of Theoretical Biology, 230:351–358.
Cagnolo, L; Valladares, G.; Salvo, A.; Cabido, M.; Zak, M. 2009. Habitat fragmentation and species loss across three interacting trophic levels: Effects of life-history and food-web traits. Conservation Biology, 23(5):1167-1175.
Crist, T. O.; Pradhan-Devare, S. V.; Summerville. 2006. Spatial variation in insect community and species responses to habitat loss and plant community composition. Oecologia, 147:510-521.
Elton, C. S. 1927. Animal Ecology. New York: The Macmillan Company, 207pp.
Fahrig, L. 2003. Effects of hábitat fragmentation on biodiversity. Annual Review of Ecology, Evolution and Systematics, 34: 487-515.
Fleury, M. & Galetti, M. 2006. Forest fragment size and microhabitat effects on palm seed predation. Biological Conservation, 131:1-13.
Grinnell, J. & Swarth, H. S. 1913. An account of the birds and mammals of the San Jacintoarea of southern California with remarks upon the behavior of geographic races on the margins of their habitats. University of California Publications in Zoology, 10(10):197-406.
Johnson, R. H. 1910. Determinate evolution in the color-pattern of the lady-beetles. Washington: Carnegie Instiution of Washington, 103pp.
Leibold, M. A. 1995. The niche concept revisited: mechanistic models and community context. Ecology, 76(5):1371-1382.
Nour, N.; Currie, D.; Matthysen, E.; Van Damme, R.; Dhondt. 1998. Effects of habitat fragmentation on provisioning rates, diet and breeding success in two species of tit (great tit and blue tit). Oecologia, 114:522-530.
Pineda, E.; Moreno, C.; Escobar, F. & Halffter, G. 2005. Frog, bat, and dung beetle diversity in the Cloud Forest and coffee agroecosystems of Veracruz, Mexico. Conservation Biology, 19(2):400-410.
Schoener, T. W. Ecological niche. Cap. I.1. In. Levin, A. A. 2009. The Princeton Guide to Ecology, p.842.
Tabarelli, M.; Mantovani, W.; Peres, C. A. 1999. Effects of habitat fragmentation on plant guild structure in the montane Atlantic forest of southeastern Brazil. Biological Conservation, 91:119-127.
Resiliência Ecológica e Sócio-ecológica
Paula Elias Moraes
No final da década de 60, Lewontin (1969) propôs a existência de estados estáveis alternativos em comunidades e ecossistemas, contrapondo a ideia, até então vigente, que no equilíbrio só há um ponto de estabilidade (Scheffer 2009). Por algumas décadas, a ideia de Lewontin (1969) se manteve no campo da teoria, inclusive alguns modelos teóricos surgiram dando apoio à existência de estados estáveis alternativos (Holling 1973; May 1977). Entretanto o crescente interesse dos ecólogos acerca desse tema tem levado ao aumento no número de estudos empíricos evidenciando que um sistema pode mudar para outro estado estável (Dublin et al. 1990; Persson et al. 2007; Levin e Lubchenco 2008; Staver et al. 2011; Hirota et al. 2011). Além disso, os sistemas ecológicos não respondem somente de forma linear, previsível e controlável as perturbações (Folke et al 2002), mas estão sujeitos as imprevisibilidades impostas pelo meio, respondendo de forma não linear e brusca, ou seja, a partir de transições críticas (Scheffer et al. 2001; Scheffer 2009). As mudanças bruscas em um sistema são, geralmente, impossíveis de serem previstas e demandam grande investimento para serem revertidas (Folke et al. 2002).
Sabe-se que a estabilidade nos sistemas dinâmicos corresponde à persistência do sistema próximo do seu estado de equilíbrio e pode ser medida pela resiliência (Gunderson 2000; Levin 2009). A resiliência de um sistema pode ser definida de duas formas, refletindo diferentes aspectos da estabilidade (Gunderson 2000). Pela definição mais tradicional, “engineering resilience” (Holling 1996) é o tempo que o sistema leva para retornar ao ponto de equilíbrio estável após uma perturbação. Tal definição implica na existência de uma estabilidade global ao redor de um único ponto de equilíbrio (Figura 1A). “Engineering resilience” é usada pelos físicos, matemáticos e engenheiros que estudam sistemas dinâmicos simples. Em contrapartida, Holling (1973) descreve a existência de múltiplos estados de equilíbrio ou bacias de atração em um sistema, implicando na inexistência de estabilidade global (Figura 1B). Neste sentido, a resiliência é a capacidade de um sistema absorver um distúrbio sem mudar de estado e Holling (1996) se refere a essa definição como “ecological resilience”. “Ecological resilience” é usada em sistemas ecológicos que são complexos e possuem estados alternativos presentes em questões de cunho ambiental (e.g. perda da biodiversidade, mudanças climáticas, restauração ecológica e desenvolvimento sustentável) (Holling 1996). De uma forma geral, a “engineering resilience” foca na manutenção da eficiência das funções (ou relações) e constância em um sistema e na previsibilidade do meio, enquanto que a “ecological resilience” foca na manutenção da existência das funções e mudança em um sistema e na imprevisibilidade do meio (Petterson et al. 1998).
A existência de estados alternativos tem profundas implicações na forma como o sistema se comporta frente às mudanças ambientais. Os sistemas ecológicos podem responder de forma gradual às mudanças ambientais (Figura 2A), ser tolerantes ao longo do gradiente ambiental e responder fortemente nos níveis críticos (Figura 2B) ou, em situações extremas, podem mudar bruscamente para outro estado de equilíbrio, a partir de uma transição catastrófica (Figura 2C) (Scheffer 2009). De acordo com o gráfico c, a passagem brusca do estado I para o II ocorre sob a condição x1 e para que o sistema retorne ao estado inicial é preciso que as condições ambientais sejam restauradas a um ponto crítico bastante anterior (x2) ao ponto crítico antes do colapso. Assim, a mudança de um estado alternativo para outro em diferentes condições críticas é a chamada histerese (Van Nes e Scheffer 2004; Scheffer 2009). Nesses sistemas, a resiliência diminui com a proximidade dos pontos críticos (x1 e x2), de forma que pequenas perturbações podem desencadear a mudança brusca de estado (Scheffer et al. 2009). Há dois obstáculos em estudos de sistemas com histerese: (i) impossibilidade em prever os pontos críticos e (ii) requerimento de grandes investimentos para restaurar um sistema ao seu estado inicial (Scheffer et al. 2001; Folke et al. 2002).
Estudos apontam que a diversidade biológica parece aumentar a resiliência de um ecossistema, o que é importante para garantir a sua integridade. (Walker 1995; Tilman et al. 1996; Walker et al. 1999; Peterson et al. 1998; Elmqvist et al. 2003). Entende-se por diversidade biológica: a diversidade de grupos funcionais no ecossistema e a diversidade de espécies dentro de cada grupo funcional. As espécies podem ser divididas em grupos funcionais baseados em seus papéis ecológicos (e.g. decompositores, polinizadores e dispersores de sementes) que contribuem para o funcionamento do ecossistema (Clarke 1954). Dentro desse contexto, um conceito importante é a redundância ecológica (i.e. espécies ecologicamente similares no mesmo grupo funcional), de forma que, se uma espécie desaparecer, a sua função ecológica não estará perdida, caso haja outra espécie que desempenhe a mesma função (Walker 1992; Walker 1995; Peterson et al. 1998). Neste sentido, a diversidade de espécies dentro do grupo funcional é importante porque as espécies apresentam diversidade de respostas frente a uma mudança ambiental, contribuindo, novamente, para a manutenção de uma função no ecossistema (Norberg et al. 2001; Luck et al. 2003).
Grande parte dos produtos que utilizamos no dia-a-dia para nosso conforto e sobrevivência vem dos serviços ecossistêmicos (e.g. clima ameno, água, ar, alimento e combustível) presentes nos sistemas ecológicos. No entanto, a provisão de serviços ecossistêmicos pode ser comprometida pelas mudanças ambientais causadas pelo homem (Elmqvist et al. 2003). Estudos em recifes de corais, lagos, oceanos, florestas e regiões áridas evidenciam que as atividades antrópicas alteram a resiliência desses ecossistemas, causando mudanças bruscas de estado (Scheffer et al. 2001; Gunderson 2000; Folke et al 2004). As atividades antrópicas diminuem a resiliência nos ecossistemas, removendo a diversidade de respostas, grupos funcionais ou níveis tróficos inteiros e alterando a magnitude, frequência e duração dos distúrbios. Essas atividades podem ter efeitos sinergéticos, tornando o ecossistema mais vulnerável às mudanças que antes podiam ser absorvidas (Folke et al. 2002). Consequentemente, pequenos distúrbios já podem desencadear mudanças de estado bruscas, indesejadas e, muitas vezes, irreversíveis, comprometendo a provisão de serviços ecossistêmicos (Folke et al. 2004).
Com a crescente transformação dos ecossistemas pelo homem tem se dado maior importância para estudos que abordam os sistemas social e ecológico de forma integrada (Folke et al. 2002). Além da “ecological resilience” e “engineering resilience” citadas nos parágrafos anteriores, há também a “social-ecological resilience” que inclui o conhecimento dos moradores locais para um melhor entendimento do ecossistema (Berkes et al. 2000; Olsson e Folke 2001). Esse conceito pode ser interpretado como: (i) a quantidade de distúrbio que um sistema pode absorver e continuar no mesmo estado; (ii) o grau que o sistema é capaz de se reorganizar; (iii) o grau que o sistema pode construir e aumentar a capacidade de aprendizado e adaptação (Folke 2006). Neste sentido, espera-se que os sistemas social e ecológico estejam em um mesmo estado de equilíbrio, sendo fundamental o aprendizado e adaptação da população humana frente às imprevisíveis mudanças ambientais que podem ocorrer no ecossistema (Folke 2006).
O objetivo do meu projeto de mestrado é avaliar o efeito sinergético da perda do habitat e da caça sobre a persistência de espécies de mamíferos de maior porte em região de fronteira agrícola da Amazônia Oriental, a partir de entrevistas com os moradores locais. Os diferentes tipos de distúrbios antrópicos (e.g. caça, extração de produto florestal madeireiro, agricultura de corte e queima, perda e fragmentação de habitat) comumente ocorrem simultaneamente em paisagens de florestas tropicais, de forma que seus efeitos podem ser sinergéticos (Laurence e Peres 2006; Peres et al. 2010). Além disso, segundo Holling (1973), resiliência é a propriedade do sistema e a persistência ou probabilidade de extinção é o resultado da diminuição da resiliência. Pode-se pensar que as ameaças que resultam em perda de espécies tornam as populações pouco resilientes e a diminuição linear nas abundâncias das espécies dá lugar ao colapso repentino e imprevisível. Assim, a interação entre perda de habitat e caça deve ocorrer porque em fragmentos florestais menores os mamíferos apresentam populações pequenas, vulneráveis e mais acessíveis aos caçadores em relação às florestas contínuas (Chiarello 1999; Laurance et al. 2000).
A perda de populações de mamíferos pode ter implicações para a dinâmica de florestas tropicais, uma vez que esses animais exercem funções ecológicas chaves. Muitos são polinizadores e dispersores de sementes (Asquith et al. 1997; Stoner et al. 2007) e alguns são predadores de topo, podendo desencadear cascatas tróficas (Hairston et al. 1960; Roemer et al. 2009; Terborgh e Estes 2010). Além de sua importância ecológica, os mamíferos são também importantes para o homem por serem fonte importante de alimento para populações próximas as florestas tropicais (Dwyer e Minnegal 1991; Redford 1992; Wilkie e Carpenter 1999). Com isso, o conceito de resiliência tem se tornado fundamental em ações de manejo de recursos naturais (Folke et al. 2002). De forma que, um manejo efetivo requer um bom entendimento sobre a dinâmica do ecossistema e o bem-estar da população humana, a partir da exploração sustentável das espécies.
Referências Bibliográficas
Asquith NM, Wright SJ, Clauss MJ (1997) Does mammal community composition control recruitment in Neotropical Forests? Evidences from Panama. Ecology 78(3): 941-946.
Berkes F, Folke C (2000) Linking Social and Ecological Systems: Management Practices and Social Mechanisms for Building Resilience. Cambridge University Press.
Clarke GL (1954) Elementes of Ecology. Harvard University and Woods Hole Oceanographic Institution.
Chiarello AG (1999) Effects of fragmentation of the Atlantic forest on mammal communities in south-eastern Brazil. Biological Conservation 89: 71-82.
Dublin HT, Sinclair ARE & McGlade J (1990) Elephants and fire as causes of multiple stable states in the Serengeti–Mara woodlands. J. Anim. Ecol. 59: 1147-1164.
Elmqvist T, Folke C, Nyström M, Peterson G, Bengtsson J, Walker B, Norberg J (2003) Response diversity, ecosystem change, and resilience. The Ecological Society of America: 488-494.
Folke C, Carpenter S, Elmqvist T, Gunderson L, Holling CS, Walker B (2002) Resilience and Sustainable Development: Building Adaptive Capacity in a World of Transformations. Ambio 31(5): 437-440.
Folke C, Carpenter S, Walker B, Scheffer M, Elmqvist T, Gunderson L, Holling CS (2004) Regime shifts, resilience, and biodiversity in ecosystem management. Annu. Rev. Ecol. Evol. Syst. 35: 557–81.
Folke C (2006) Resilience: The emergence of a perspective for social–ecological systems analyses. Global Environmental Change 16: 253–267.
Gunderson LH (2000) Ecological resilience—in theory and application. Annu. Rev. Ecol. Syst. 2000. 31:425–39.
Hairston NG, Smith FE, Slobodkin LB (1960) Community Structure, Population Control, and Competition. The American Naturalist 94(879): 421-425.
Hirota MH, Van Nes EH, Scheffer M (2011) Global Resilience of Tropical Forest and Savanna to Critical Transitions. Science 334(6053): 232-235.
Holling CS (1973) Resilience and stability of ecological systems. Annual Review of Ecology and Systematics 4: 1–23.
Holling CS (1996) Engineering resilience versus ecological resilience. In: Schulze PC (Ed). Engineering within ecological constraints. Washington DC: National Academy Press.
Laurance WF, Vasconcelos HL, Lovejoy TE (2000) Forest loss and fragmentation in the Amazon: implications for wildlife conservation. Oryx 34(1): 39-45.
Levin SA (2009) The Princeton Guide to Ecology. Princeton University Press.
Levin SA, Lubchenco J (2008) Resilience, Robustness, and Marine Ecosystem-based Management. BioScience 58(1): 27-32.
Lewontin RC (1969) The meaning of stability. Brookhaven Symp. Biol. 22: 13-23.
Luck GW, Gretchen CD, Ehrlich PR (2003) Population diversity and ecosystem services. TRENDS in Ecology and Evolution 18: 331-336.
May RM (1977) Thresholds and breakpoints in ecosystems with a multiplicity of stable states. Nature 269: 471-477.
Norberg J, Swaney DP, Dushoff J, Lin J, Casagrandi R, Levin SA (2001) Phenotypic diversity and ecosystem functioning in changing environments: A theoretical framework. PNAS 98(20).
Olsson P, Folke C (2001) Local Ecological Knowledge and Institutional Dynamics for Ecosystem Management: A Study of Lake Racken Watershed, Sweden. Journal Ecosystems 4(2): 85-104.
Peres CA, Laurance WF (2006) Synergistic effects of simultaneous environmental changes. In: Peres CA, Laurance WF, editors. Emerging threats to tropical forests: University of Chicago Press: 81-86.
Peres CA, Gardner TA, Barlow J, Zuanon J, Michalski F et al. (2010) Biodiversity conservation in human-modified Amazonian forest landscapes. Biological Conservation 143: 2314-2327.
Persson L, Amundsen PA, De Roos AM, Klemetsen A, Knudsen R, Primicerio R (2007) Culling Prey Promotes Predator Recovery – Alternative States in a Whole – Lake Experiment. Science 316: 1743-1746.
Peterson G, Allen CR, Holling CS (1998) Ecological Resilience,Biodiversity, and Scale. Ecosystems 1: 6–18. Redford KH (1992) The Empty Forest. BioScience 42(6): 412-422.
Roemer GW, Gompper ME, Valkenburgh BV (2009) The Ecological Role of the Mammalian Mesocarnivore. BioScience 59(2): 165-173.
Scheffer, M (2009). Critical Transitions in Nature and Society, Princeton University Press.
Scheffer M, Carpenter S, Foley JA, Folke C, Walker B (2001). Catastrophic shifts in ecosystems. Nature 413: 591-596.
Staver AC, Archibald S, Levin SA (2001) The Global Extent and Determinants of Savanna and Forest as Alternative Biome States. Science 334: 230-232.
Stoner KE, Vulinec K, Wright SJ, Peres CA (2007) Hunting and plant community dynamics in tropical forests: a synthesis and future directions. Biotropica 39(3): 385-392.
Tilman D, Wedin D, Knops J (1996) Productivity and sustainability influenced by biodiversity in grasslands ecosystems. Nature 379: 718-720.
Van Nes EH, Scheffer M (2004) Large Species Shifts Triggered by Small Forces. The American Naturalist 164(2): 255-266.
Walker BH (1992) Biological diversity and ecological redundancy. Conservation Biology 6: 18–23.
Walker BH (1995) Conserving Biological Diversity through Ecosystem Resilience. Conservation Biology 9(4): 747-752.
Walker BH, Kinzig A, Langridge J (1999). Plant Attribute Diversity, Resilience, and Ecosystem Function: The Nature and Significance of Dominant and Minor Species. Ecosystems 2: 95–113.
Wilkie DS, Carpenter JF (1999) Bushmeat hunting in the Congo Basin: an assessment of impacts and options for mitigation. Biodiversity and Conservation 8: 927-955.
Síntese conceitual da ecologia de comunidades e as invasões biológicas
Fernando Silvério Ribeiro
A história da ecologia de comunidades não tem um início muito bem definido, mas foi a partir da década de 1960 que a disciplina iniciou um claro desenvolvimento teórico (Vellend, 2010). Ao longo dos anos, inúmeros trabalhos identificaram novos processos importantes na estruturação das comunidades ecológicas, muitas vezes sem a preocupação explícita de integrá-los aos já conhecidos. Apenas em 2010, com o artigo publicado por Vellend, a disciplina parece ter encontrado uma síntese teórica capaz de abarcar todo o conhecimento estabelecido até então. O destaque do trabalho foi estabelecer que apenas quatro processos básicos, individualmente ou em diferentes combinações, são capazes de gerar todos os padrões encontrados. Os quatro processos são: seleção, deriva, especiação e dispersão. O artigo define seleção como diferenças determinísticas de fitness entre indivíduos de diferentes espécies; deriva como mudanças aleatórias na abundância relativa de espécies; especiação como o surgimento de novas espécies; e dispersão como o movimento de organismos pelo espaço.
Paralelamente ao desenvolvimento da ecologia de comunidades, surgia em 1958, com o trabalho pioneiro de Elton, uma nova área de estudos, as invasões biológicas. A nova disciplina seguiu uma linha própria, com terminologia e conceitos únicos. Assim como na ecologia de comunidades, diversos estudos em sistemas específicos geraram resultados aparentemente contraditórios, levantando a questão de se seria possível alguma generalização teórica. Milbau et al. (2009) afirmaram que provavelmente os cientistas estavam estudando diferentes peças de um mesmo quebra-cabeça e salientam a importância da integração de resultados. Alguns trabalhos tentam abordar essa questão (revisado por Gurevitch et al., 2011), sugerindo diferentes quadros conceituais, potencialmente integradores, para lidar com as invasões biológicas. Um problema apontado pelos autores da revisão é o fato desses quadros conceituais não interagirem explicitamente com outras áreas da ecologia, mantendo, por exemplo, terminologia própria, mesmo quando o significado teórico pode ser melhor compreendido através de outros conceitos já bem estabelecidos na ecologia.
Apesar de algumas especificidades, como a obrigatoriedade da existência de espécies não nativas, as questões pertinentes às invasões biológicas tem relação com a riqueza, composição e abundância de espécies na comunidade, ou seja, suas perguntas assemelham-se muito às da ecologia de comunidades. Dessa forma, penso que uma maior aproximação entre invasões biológicas e ecologia de comunidades pode ajudar a esclarecer alguns dos conceitos largamente utilizados em estudos de invasões. Abaixo, discutirei como meu projeto de pesquisa de mestrado, estruturado parcialmente com base na teoria de invasões biológicas, pode ser também entendido através dos conceitos de ecologia de comunidades.
Em minha pesquisa, procuro entender os determinantes e os impactos da invasão de cachorros domésticos (Canis familiaris) em remanescentes florestais de paisagens fragmentadas na Mata Atlântica. Com relação aos determinantes, irei analisar os dois principais fatores relacionados ao sucesso de invasões: pressão de propágulos e distúrbios. Pressão de propágulos é uma medida do número e da distribuição espacial e temporal dos indivíduos da espécie exótica em uma região. Logo, um componente desse conceito é a taxa de fecundidade da espécie, que por sua vez contribui para o fitness e, portanto, faz parte do conceito de seleção de Vellend. Normalmente, a seleção também deveria influir na distribuição espacial e temporal da espécie, porém o cachorro é fortemente subsidiado pelo homem e, portanto, sua distribuição deve ser mais definida pela dispersão mediada por ação humana. Assim, conclui-se que pressão de propágulos nada mais é do que uma combinação de seleção e dispersão e, para entendê-la de fato, preciso analisar mais profundamente esses dois aspectos. Isso gera a necessidade, por exemplo, de investigar os motivos pelos quais as pessoas criam cachorros para compreender os padrões de dispersão dos mesmos pelas áreas rurais. Outro aspecto interessante a ser abordado é a taxa com que os proprietários de cachorros castram os seus animais.
Por outro lado, distúrbios estão relacionados à “invasibilidade” (invasibility) do ambiente e podem alterar, por exemplo, os tipos e quantidades de recursos disponíveis. Nesse novo ambiente, o regime de seleção estabelecido ao longo da história evolutiva é alterado. Interações entre espécies, como competição e predação, podem, deterministicamente, favorecer a espécie exótica, resultando em sucesso da invasão. No caso dos cachorros, o distúrbio que irei abordar é a perda de habitat nativo. Descendente de um ancestral com preferência por áreas abertas, o cachorro deve beneficiar-se da degradação de florestas e se locomover mais facilmente pelas paisagens. Novamente fica claro o papel do conceito de seleção como determinante da probabilidade de invasão do cachorro.
Apesar da simplicidade dos exemplos apresentados, não acho que outros conceitos ou hipóteses relativos às invasões biológicas não possam ser tratados da mesma maneira. Hipóteses como “escape de inimigos” (Keane e Crawley, 2002), “nichos vazios” (Hierro et al., 2005) e “heterogeneidade ambiental” (Melbourne et al., 2007) entre outras, estão sempre relacionadas às interações determinísticas (e, portanto, seleção) entre a espécie exótica, nativas e ambiente e/ou a demografia da espécie exótica (seleção e dispersão). Além disso, resultados contraditórios ou inesperados não podem descartar as flutuações aleatórias na abundância de espécies (deriva) como uma possível explicação.
Referências bibliográficas
Elton, C.S. 1958. The ecology of invasions by animals and plants. Methuen, London.
Gurevitch, J., Fox, G.A., Wardle, G.M., Inderjit, Taub, D. 2011. Emergent insights from the synthesis of conceptual frameworks for biological invasions. Ecology Letters 14: 407-418
Hierro, J.L., Maron, J.L., Callaway, R.M. 2005. A biogeographical approach to plant invasions: the importance of studying exotics in their introduced and native range. Journal of Ecology 93: 5-15
Keane, R.M., Crawley, M.J. 2002. Exotic plant invasions and the enemy release hypothesis. Trends in Ecology and Evolution 17: 164–170
Melbourne, B.A., Cornell, H.V., Davies, K.F., Dugaw, C.J., Elmendorf, S., Freestone, A.L., Hall, R.J., Harrison, S., Hastings, A., Holland, M., Holyoak, M., Lambrinos, J., Moore, K., Yokomizo, H. 2007. Invasion in a heterogeneous world: resistance, coexistence or hostile takeover? Ecology Letters 10: 77–94.
Milbau, A., Stout, J.C., Graae, B.J., Nijs, I. 2009. A hierarchical framework for integrating invasibility experiments incorporating different factors and spatial scales. Biological Invasions 11: 941-950
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quaterly Review of Biology 85: 183-206
A Diversidade em Sistemas Sócio-Ecológicos
Carlos Frederico Alves de Vasconcelos Neto
Sistemas sócio-ecológicos (SSE) são criados a partir da inter-relação entre povos e os recursos naturais que os rodeia, ou seja, a interação entre o sistema social e ecológico. Duas teorias principais servem de base para facilitar a compreensão dos sistemas sócio-ecológicos, são elas, “teoria geral dos sistemas” e “teoria dos sistemas adaptativos complexos” (Berkes et al., 2003). Em suma, enquanto a teoria dos sistemas estuda entidades estáticas conectadas por relações lineares e que estão em constante equilíbrio, a teoria da complexidade postula relações não lineares e em constante mudança, comportamentos complexos que evoluem das relações locais entre os componentes do sistema ao longo do tempo (Manson, 2001). Apesar destas diferenças, essas duas teorias são complementares.
A ecologia de comunidades tem como um dos principais objetivos explicar as diferenças na diversidade entre comunidades. No entanto, vários estudos não consideram o homem como agente criador/modificador de diversidade. O uso de abordagens integrativas são cada vez mais necessárias para uma real compreensão do papel dos seres humanos na natureza. Nesta perspectiva, a teoria dos sistemas adaptativos complexos leva em consideração aspectos da adaptação e variabilidade para entender o funcionamento e a dinâmica dos sistemas em mudança, ou seja, como uma organização em escala superior surge, se mantêm e é reorganizada por processos com escalas inferiores (Levin et al., 1998).
A teoria geral dos sistemas foca-se na hierarquia e interdependência entre os componentes do sistema, enquanto a teoria da complexidade propõe conceitos como não-linearidade, variabilidade, hierarquia, escala e multi-equilíbrio (Stacey, 1996). Estas teorias e conceitos contrastam a ideia estática de capacidade suporte e clímax apontada por Scoones (1999), destacando formas de manejo com base no ciclo de renovação adaptativa proposto por Holling (2001), onde as fases de exploração, conservação, liberação e reorganização determinam a dinâmica e resposta dos sistemas frente às situações de distúrbios ecológicos e sociais. Ou seja, os sistemas ecológicos podem apresentar diferentes níveis resiliência, na medida que se tornam mais adaptáveis as modificações humanas (Walker et al., 2004).
Alguns autores (Anderson, 2010; Casas et al., 2007; Campbell et al., 2006) argumentam que o manejo realizado pelos povos que habitaram a Mesoamérica são os responsáveis pela formação de verdadeiras florestas antrópicas - consórcio de espécies domesticadas e de importância econômica com espécies selvagens. Onde observaram que ao longo dos anos de manejo as comunidades de fauna e flora apresentaram diversidade de espécies superior à habitats naturais, devido a maior produtividade destas áreas. Com base neste pressuposto, meu projeto tem como objetivo principal compreender como áreas com diferentes graus de antropização, mediam e interferem a distribuição e abundância da de mamíferos de médio e grande porte.
Para avaliar a resiliência da área é preciso entender seus mecanismos e dinâmicas internas, para isso é necessário assumirmos como hipótese que estes sistemas sócio-ecológicos se comportam como sistemas complexos. E podem ser caracterizados como sendo resultado de um processo cotidiano de adaptação entre um dado povo e o seu ecossistema, onde os processos sociais e ecológicos são dependentes dos níveis de escala e organização considerados. (Altieri, 2002; Gomes & Borba, 2003; Walker et al., 2004).
Referências Bibliográficas
Altieri, M.A. 2002. Agroecology: the science of natural resource management for poor farmers in marginal environments. Agriculture, Ecosystems and Environment, 93(1-3): 1-24;
Anderson, E.N. 2010. Managing Maya Landscapes: Quintana Roo, Mexico. In: Landscape Ethnoecology: Concepts of Biotic and Physical Space, (Orgs.) Johnson, L.M. & Hunn, E.S.. Berghahn Books. 332pp.
Berkes, F.; Colding, J.; Folke, C. 2003. Navigating social-ecological systems: building resilience for complexity and chance. Cambridge: Cambridge University Press;
Campbell, D.G.; Ford, A.; Lowell, K.; Walker, J.; Lake, J.K.; Ocampo-Raeder, C.; Townesmith, A.; Balick, M. 2006. The Feral Forests of the Eastern Peten. In: Time and Complexity in the Neotropical Lowlands, (Orgs.) Erickson, C. & Balée, W. Columbia University. 21–55pp;
Casas, A.; Otero-Arnaiz, A.; Pérez-Negrón, E.; Valiente-Banuet, A. 2007. In situ management and domestication of plants in Mesoamerica. Annals of Botany, 100(5): 1101–1015p;
Gomes, J.C.C.; Borba, M. 2003. Limites e possibilidades da agroecologia como base sociedades sustentáveis. Ciencia & Ambiente, 27: 5-14;
Holling, C.S. 2001. Understanding the complexity of economic, ecological, and social systems. Ecosystems, 4: 390-405;
Levin, S.A.; Barret, S.; Aniyar, S. 1998. Resilience in natural and socioeconomic systems. Environment and Development Economics, 3(2): 222-235;
Scoones, I. 1999. New ecology and the social sciences: what prospects for a fruitful engagement? Annual Review of Anthropology, 28(1): 479-507;
Stacey, R. 1996. Complexity and creativity in organizations. San Francisco: Berrett Koehler;
Walker, B.; Holling, C.S.; Carpenter, S.R.; Kinzig, A. 2004. Resilience, Adaptability and Transformability in Social-Ecological Systems. Ecology and Society 9(2): 1-9;