Tabela de conteúdos
Ensaios 2024
Houston, (do) we have a problem (?) - Estados estáveis alternativos sob uma perspectiva de análise de sucesso em projetos de restauração de florestas
Giovanni De Martella Martins Fontes
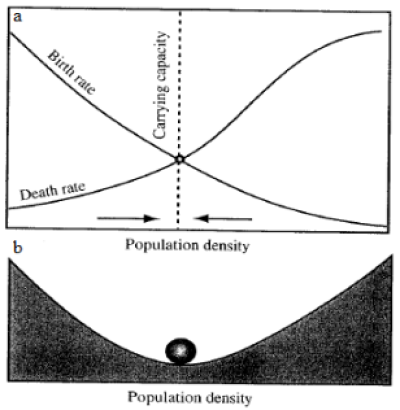
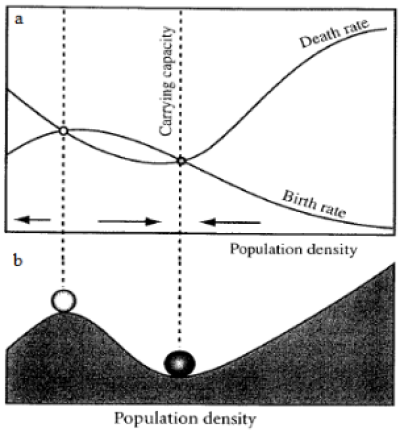
Aproximadamente nos anos 70, surgiu na ecologia a discussão sobre a existência de ambientes com estados estáveis alternativos (Lewontin, 1969; Sutherland, 1974; May, 1977). Tal conceito é delineado pela concepção de equilíbrio estável em sistemas dinâmicos, descrita com detalhes por Beisner e colaboradores (2003) e Scheffer (2009). Quando as taxas de natalidade e mortalidade em uma população se igualam, mantendo seu número de indivíduos, dizemos que ela se encontra em equilíbrio - o que geralmente acontece quando a população atinge a capacidade suporte (K) do ambiente que habita (Figura 1a). Esse equilíbrio é dito “estável” quando vemos um comportamento semelhante ao observado na Figura 1b (Scheffer, 2009) com a bola na bacia de atração em formato de “U”: mesmo com possíveis mudanças na densidade populacional (colocar a bola em qualquer ponto da bacia), há uma tendência grande de retorno para este ponto de equilíbrio (fundo da bacia, também chamado de atrator - Scheffer, 2009). Tal funcionamento é ligeiramente modificado se considerarmos a existência de múltiplos estados estáveis, pois nessa situação há mais de um ponto de equilíbrio estável. A Figura 2a mostra um exemplo do funcionamento de uma população com forte Efeito Allee - população com tendência alta de ser extinta quando em baixas densidades populacionais (Scheffer, 2009) - situação em que podem ser encontrados 2 pontos de equilíbrio estável (um na capacidade suporte (K) e outro quando a densidade populacional cai para zero - Scheffer, 2009). Estes pontos de equilíbrio estáveis são, por sua vez, separados por um ponto de equilíbrio instável, em que as taxas de mortalidade e natalidade são igualadas, porém a menor perturbação ou alteração nas condições ambientais é suficiente para “empurrar a bola para dentro de uma das bacias” (Figura 2b).
Figura 1: (a) Variação das taxas de mortalidade e de natalidade de uma população de acordo com a variação de sua densidade. As setas indicam uma tendência de mudança na densidade populacional convergindo para o ponto de equilíbrio estável, onde as taxas de mortalidade e natalidade se igualam (capacidade suporte - K). (b) Analogia gráfica do fenômeno observado na imagem anterior, apelidada de “bacia de atração”. Ilustra a situação em que, mesmo com a existência de perturbações, a bolinha voltará para o ponto atrator (Retiradas e adaptadas de Scheffer, 2009).
Figura 2: (a) Variação das taxas de mortalidade e de natalidade de uma população de acordo com a variação de sua densidade. As setas indicam uma tendência de mudança na densidade populacional, convergindo para o ponto de equilíbrio estável (bolinha escura - K) e divergindo do ponto de equilíbrio instável (bolinha clara). Tal comportamento pode ser observado em populações com forte Efeito Allee. (b) Analogia gráfica do fenômeno observado na imagem anterior com duas “bacias de atração” - dois pontos de equilíbrio estáveis (0 e K) - e um cume - ponto de equilíbrio instável. (Retiradas e adaptadas de Scheffer, 2009)
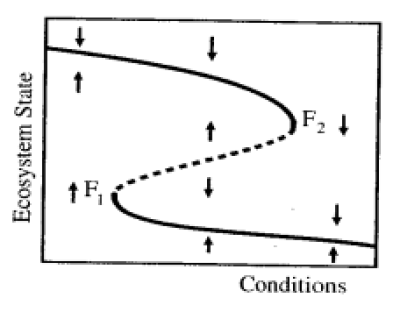
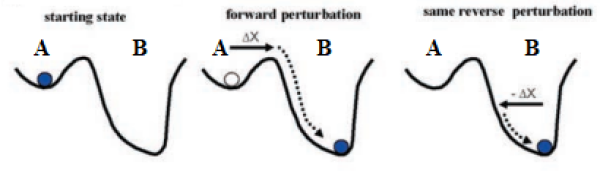
No entanto, quando se considera a existência de estados estáveis alternativos, deve-se levar em conta também os efeitos possivelmente gerados por essa dinâmica. (Scheffer, 2009). Nesse cenário, é possível observar padrões diferentes de equilíbrio estável existindo para condições ambientais semelhantes em momentos distintos, conforme ilustrado na Figura 3 (Scheffer, 2009). A curva dobrada nessa imagem mostra uma descontinuidade (linha tracejada) entre esses estados, indicando que essa mudança de um estado para outro é geralmente abrupta e depende muito da intensidade da perturbação ou mudança nas condições ambientais. Algo que pode acontecer com a existência de estados estáveis alternativos é uma certa discrepância nos pontos de transição entre um estado e outro, padrão chamado de histerese (Beisner et al., 2003). Uma característica marcante desse padrão é a diferenciação na variação necessária nas condições ambientais para a troca de um estado para o outro, como ilustrado na Figura 4: de um ponto A para um ponto B, é necessária determinada mudança nas condições ambientais, que não é suficiente para se voltar de B para A (como se as “bacias de atração” tivessem diferenças no seu poder atrativo - Beisner et al., 2003). Ou seja, diz-se que esse sistema tem resiliências diferentes em cada um desses estados de equilíbrio estável, por mostrar diferenças em cada um dos equilíbrios estáveis na sua capacidade de retornar a condição original após uma perturbação ou alteração nas condições ambientais (Beisner et al., 2003; Scheffer, 2009).
Figura 3: Representação gráfica da variação do estado do ecossistema em resposta às condições ambientais. As setas indicam a tendência de deslocamento para um dos estados estáveis, dependendo do estado encontrado sob determinadas condições ambientais. F1 e F2 marcam os limites entre uma bacia de atração e a outra e a linha tracejada entre eles, um estado de equilíbrio instável. (Retirada de Scheffer, 2009).
Figura 4: Analogia gráfica das bacias de atração para um cenário de estados estáveis alternativos apresentando histerese. 𝚫X indica a perturbação e a seta contínua, o seu sentido. Note que a mesma perturbação realizada na segunda imagem é aplicada na terceira com sentido oposto, porém não é suficiente para voltar para a bacia de atração anterior (A), revelando uma diferença de resiliência entre os estados A e B. (Retirada e adaptada de Beisner et al., 2003).
Reconhecer os indícios de padrões de histerese e de transições abruptas entre estados foi essencial para se identificar a existência de estados estáveis alternativos (Westoby et al., 1989; Drake, 1990; Hobbs, 1994). Diversos exemplos que apresentam tais características foram observados na natureza: para transições críticas entre áreas florestadas, savanas e ausência de cobertura arbórea (Hirota et al., 2011), para cobertura de algas e de mexilhões em costões rochosos (Bertness et al., 2002), para florestas de pinheiros com folhas longas (Walker & Boyer, 1993) e até em casos não envolvendo dinâmicas populacionais diretamente, para mudanças catastróficas no abastecimento de reservatórios de água em São Paulo (Coutinho; Kraenkel; Prado, 2015).
Porém, para se entender ecologia de comunidades, não basta somente reconhecer os padrões na natureza. É necessário compreender a grande gama de processos e suas combinações que podem ter gerado tais padrões (Vellend, 2010). Um exemplo clássico de estados estáveis alternativos é o de lagos rasos, sendo encontrados em um estado com águas cristalinas ou em um estado com maior turbidez (Blindow et al., 1993; Scheffer et al., 1993). Nesse caso, ficou bem marcada a existência de mecanismos de feedback positivo que regularam e desencadearam os processos de transformação da paisagem. Portanto, reconhecer a existência de estados estáveis alternativos nos permite também entender um pouco mais como os processos modeladores e criadores da diversidade biológica interagem na grande caixa preta da ecologia de comunidades (Vellend, 2010), abrindo margem para descobrirmos outros padrões gerados de forma semelhante.
Além disso, estudar os estados estáveis alternativos pode ser bastante importante para delinear projetos de restauração ecológica e avaliar se obtiveram sucesso ou não (Hobbs & Norton, 1996). Para restaurar florestas, é necessário definir qual objetivo deseja-se alcançar. Somente depois de definirmos o que é de fato “sucesso” para um projeto que podemos, após sua realização, avaliar se os esforços realizados foram realmente efetivos (Hobbs & Norton, 1996). Até porque houve uma grande transformação nas técnicas e no próprio conceito de restauração, visando dar maior importância aos processos ecológicos que operam/operavam na região a ser reflorestada ao invés de focar somente em padrões pré-estabelecidos de composição vegetal e animal como metas para serem restabelecidos (Rodrigues; Brancalion; Isernhagem, 2009; Brancalion; Gandolfi; Rodrigues, 2015). Hobbs e Norton (1996) apontam algumas razões possíveis para serem elaborados projetos de restauração. São elas: 1) restaurar áreas localizadas, mas altamente degradadas, como áreas de mineração; 2) aumentar a capacidade produtiva em áreas produtivas degradadas; 3) reforçar valores conservacionistas em paisagens protegidas; 4) reforçar valores conservacionistas em paisagens produtivas. Diante das várias razões existentes para se restaurar áreas florestais, órgãos governamentais começaram a realizar esforços para propor métricas para medir o sucesso de projetos de restauração e que serviram também como metas para os implementadores desses projetos. São Paulo foi um dos estados pioneiros ao soltar a Resolução SMA 32/2014, que estabelece métricas específicas em cada bioma para serem atingidas nos seguintes parâmetros/indicadores de sucesso: cobertura do solo com vegetação nativa (%), densidade de indivíduos nativos regenerantes (ind./ha) e número de espécies nativas regenerantes (n°spp.). Com base nos resultados obtidos em plantios de restauração para cada uma dessas métricas, conclui-se se o projeto obteve sucesso ou não.
Considerar a existência dos estados estáveis alternativos permitiu também enxergar a ecologia da restauração como um conjunto de técnicas para realizar a transição entre um estado e outro (MacLeod et al., 1993; Ash et al., 1993; Grice & McIntyre 1995). Ao se constatar que florestas e savanas podem ser estados estáveis alternativos de um mesmo sistema, pode-se traçar planos para realizar a transição de um estado para outro, recuperando assim a cobertura florestal (Hirota et al., 2011). O que não significa que se trata de uma tarefa fácil, uma vez que a transição entre esses estados pode ser um desafio ainda maior quando envolve mudanças na composição do ecossistema em termos de grupos funcionais ali presentes (Hobbs, 1997). Hobbs (1994) assinala tal desafio quando diz que é mais fácil fazer a transformação de uma pastagem em outra do que realizar uma transição de pastagem para paisagem arbustiva. Ao mesmo tempo, ter conhecimento das dinâmicas de transição entre um estado e outro pode nos dar informações importantes para antever possíveis mudanças de estado indesejáveis em um projeto de restauração já em andamento, pois tais mudanças algumas vezes podem ser precedidas de sinais, mesmo que alguns sejam de difícil identificação (Scheffer et al. 2009). Por exemplo, foi observado um aumento na abundância de alguns seres vivos em lagos rasos que antecedeu diversas outras alterações no ambiente responsáveis por uma transição catastrófica entre estados estáveis (Blindow et al., 1993). Por essa razão, pode ser importante atentar para as dificuldades e problemas encontrados ao tentar restaurar áreas degradadas. Em áreas de Restinga, são apresentados como problemas para a restauração a presença de gramíneas exóticas (Loureiro et al., 2022), presença de formigas cortadeiras (Lima, 2017), solos pobres em nutrientes e com alta salinidade (Hay & Lacerda, 1984; Araujo, 1987).
Minha pesquisa se estrutura sob esse panorama. Ao analisar relatórios de projetos de restauração florestal em áreas de Restinga do estado de São Paulo, busco informações sobre os plantios (listas de espécies vegetais plantadas, diversidade funcional das espécies, entre outras), problemas recorrentes ao realizar a restauração em cada uma das áreas e se, de acordo com os critérios de análise dos órgãos responsáveis por fazer o monitoramento da restauração, o plantio foi um sucesso ou não. Com essa análise, busco responder às seguintes perguntas: 1) Houve relação significativa entre a ocorrência de determinados problemas e a quantidade de casos de sucesso observados?; 2) Qual foi a influência da diversidade funcional de espécies vegetais usadas na restauração das áreas degradadas no sucesso dos plantios? Acredito que, conforme assinalado nos parágrafos anteriores, a compreensão do que são estados estáveis alternativos e os padrões e processos associados serve de base para a temática geral de minha pesquisa, sem a qual possivelmente existiriam algumas lacunas ou mesmo nos faria recorrer a práticas já assinaladas historicamente como erros, por exemplo assumir que o plantio espécies nativas sem realizar um monitoramento do desenvolvimento das mudas é suficiente para se retornar ao estado em que a floresta se encontrava antes da degradação (Rodrigues & Gandolfi, 1998). Se todos os projetos que eu vou analisar fossem realizados dessa forma, a análise de sucesso dos plantios realizados seria influenciada, influenciando também a minha análise. Dessa forma, é reforçada a importância do conhecimento mais aprofundado dos estados estáveis alternativos para projetos de restauração e a avaliação de seu sucesso.
Referências bibliográficas
Araujo, D.S.D. Restingas: síntese dos conhecimentos para a costa sul-sudeste brasileira. São Paulo: Aciesp, 1987. 347 p.
Ash, A. J., McIvor, J. G., & Brown, J. R. (1993). Land condition and overgrazing: a management paradox for the savannas of northern Australia. In Proceedings of XVII International Grassland Congress (pp. 1930-1931).
Beisner, B. E., Haydon, D. T., & Cuddington, K. (2003). Alternative stable states in ecology. Frontiers in Ecology and the Environment, 1(7), 376-382.
Bertness, M. D., Trussell, G. C., Ewanchuk, P. J. et al. 2002. Do alternative stable community states exist in the Gulf of Maine rocky intertidal zone?. Ecology 83: 3434–3448.
Blindow I. et al. 1993. Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology 30: 159-167.
Brancalion, P. H. S., Gandolfi, S., & Rodrigues, R. R. (2015). Restauração florestal.
Coutinho, R.M., Kraenkel, R.A. and Prado, P.I., 2015. Catastrophic regime shift in water reservoirs and São Paulo water supply crisis.
Drake, J. A. (1990). Communities as assembled structures: do rules govern pattern?. Trends in Ecology & Evolution, 5(5), 159-164.
Grice, A. C., & McIntyre, S. (1995). Speargrass (Heteropogon contortus) in Australia: dynamics of species and community. The Rangeland Journal, 17(1), 3-25.
Hay, J.D.; Lacerda, L.D. Ciclagem de nutrientes no ecossistema de restinga. Rio de Janeiro: Universidade Federal Fluminense, 1984. 475p
Hirota et al. 2011. Global resilience of tropical forest and savanna to critical transitions. Science 334: 232-235.
Hobbs, R. J. (1994). Dynamics of vegetation mosaics: can we predict responses to global change?. Ecoscience, 1(4), 346-356.
Hobbs, R. J. (1997). Can we use plant functional types to describe and predict responses to environmental change. Plant functional types. Their relevance to ecosystem properties and global change, 66-90.
Hobbs, R. J., & Norton, D. A. (1996). Towards a conceptual framework for restoration ecology. Restoration ecology, 4(2), 93-110.
Lewontin RC. 1969. The meaning of stability. Brookhaven Symp Biol 22: 13–23.
Lima, D. A. V. (2017). Protocolo para restauração ecológica da restinga não-florestal em áreas de desova de tartarugas marinhas, na Praia do Forte, Bahia, Brasil.
Loureiro, N., de Souza, T. P., do Nascimento, D. F., & Nascimento, M. T. (2022). Survival, seedlings growth and natural regeneration in areas under ecological restoration in a sandy coastal plain (restinga) of southeastern Brazil. Austral Ecology, 47(2), 326-340.
Rodrigues, R. R., Brancalion, P. H. S., & Isernhagem, I. (2009). Pacto pela restauração da mata atlântica: referencial dos conceitos e ações de restauração florestal.
Rodrigues, R. R., & Gandolfi, S. (1998). Restauração de florestas tropicais: subsídios para uma definição metodológica e indicadores de avaliação e monitoramento. Recuperação de áreas degradadas.
Scheffer M, Hosper SH, Meijer ML, et al. 1993. Alternative equilibria in shallow lakes. Trends Ecol Evol 8: 275–79
Scheffer, M. 2009. Alternative Stable States. In: Critical Transitions in Nature and Society, Chapter II, pp. 11-36, Princenton University Press.
Scheffer, M., Bascompte, J., Brock, W. A., Brovkin, V., Carpenter, S. R., Dakos, V., … & Sugihara, G. (2009). Early-warning signals for critical transitions. Nature, 461(7260), 53-59.
SMA – Secretaria do Meio Ambiente do Estado de São Paulo. Resolução nº 32, de 03 de abril de 2014. Estabelece as orientações, diretrizes e critérios sobre restauração ecológica no Estado de São Paulo, e dá providências correlatas. Disponível em: <http://arquivos.ambiente.sp.gov.br/legislacao/2016/12/Resolu%C3%A7%C3%A3o-SMA-032-2014-a.pdf> . Acesso em: 18 de março de 2024.
Sutherland JP. 1974. Multiple stable points in natural communities. Am Nat 108: 859–73.
MacLeod, N. D., Brown, J. R., & Noble, J. C. (1993). Ecological and economic considerations for the management of shrub encroachment in Australian rangelands. In Proceedings II of the 10th Australian Weeds Conference and 14th Asian Pacific Weed Science Society Conference, Brisbane, Australia, 6-10 September, 1993 (pp. 118-121). Queensland Weed Society.
May, R. M. (1977). Thresholds and breakpoints in ecosystems with a multiplicity of stable states. Nature, 269(5628), 471-477.
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quaterly Review of Biology 85: 183-206.
Walker, J. L., & Boyer, W. D. (1993). An ecological model and information needs assessment for longleaf pine ecosystem restoration.
Westoby, M., Walker, B., & Noy-Meir, I. (1989). Opportunistic management for rangelands not at equilibrium. Rangeland Ecology & Management/Journal of Range Management Archives, 42(4), 266-274.
Conectividade e dispersão : persistência em dinâmica de metacomunidades
Daniela Pereira Melo Benite
O campo de ecologia de comunidades é composto por uma abundância de diferentes teorias, modelos e conceitos criados para estudar os padrões e processos que explicam riqueza, abundância e composição de espécies em comunidades. A teoria de metacomunidades surge nesse meio para unificar algumas ideias já existentes em um contexto de heterogeneidades espaço-temporais e evidenciando o conceito de dispersão. “In this book we argue that we already know many of the key aspects of community ecology but that we do not have a framework that adequately links these in an appropriate context. We argue that the missing link that can provide this context is the combination of spatial and interaction processes that characterize metacommunity ecology.” (Leibold, Chase, 2018)
O objetivo deste texto não é discutir sobre a teoria de metacomunidades como um todo, pois ela é extensa, complexa e abrange assuntos como dinâmicas de manchas, efeitos de massa, filtragem de espécies e dinâmicas neutras. O seu propósito é, mais especificamente, definir e discutir sobre dois conceitos essenciais e abrangentes tanto para metacomunidades quanto para ecologia no geral e por último brevemente inferir como os conceitos de conectividade e dispersão afetam a conservação de espécies. Dispersão é o movimento de organismos de um lugar de residência para outro (Vellend, 2016) e é preciso enfatizar que a dispersão é distinta de outros processos de movimentos cíclicos como a migração sazonal. A dispersão só é possível quando os lugares de residência ou pedaços de habitat possuem algum nível de conexão entre eles. No contexto de metacomunidades, a conectividade refere-se à medida com que diferentes comunidades estão interligadas e como a dispersão de espécies entre essas comunidades é facilitada ou restringida. Autores como Holyoak e P. Lawler (1996) mostram que às vezes é justamente a restrição da dispersão, portanto, uma menor conectividade, que mantém a persistência de algumas dinâmicas entre populações de diferentes espécies. “In addition to influencing patterns of diversity, dispersal limitation can alter the nature and strengths of species interactions in a local community. For example, dispersal limitation can allow similar (or even equivalent) competitors to coexist for long periods of time. Likewise, when predators are dispersal limited, prey that would otherwise not persist with a predator locally can do so[…] ”(Leibold, Chase, 2018)
Os conceitos de dispersão e conectividade em si já existiam para os ecólogos, mas muitas vezes estavam desconexos e não existia um framework para aplicar esses conceitos consistente e conjuntamente em ecologia de comunidades. Além disso, apesar de existirem, eles raramente eram o foco. “[…] ecologists quite rightly perceive that the huge research effort in community ecology, which is still ongoing, has not produced much in the way of patterns, or workable, contingent rules. […]the major weakness of traditional community ecology is its overwhelming emphasis on localness.”(Lawton 1999)
Antes do surgimento da teoria de metacomunidades, as comunidades eram frequentemente tratadas como sistemas completamente isolados e fechados, sem considerar a conectividade entre diferentes habitats e a migração de espécies entre eles. Desenvolvida considerando a teoria da biogeografia de ilhas proposta em 1960 por McArthur e Wilson, a teoria de metacomunidades, proposta por Hanski & Gilpin em 1991, trouxe à tona a importância da conectividade e da dispersão na dinâmica das comunidades e expandiu o framework de apenas escalas locais para locais e regionais. Com o passar do tempo após o surgimento da teoria de metacomunidades muitos estudos surgiram para aplicar os conceitos neste novo framework, incluindo estudos que focaram na importância da dispersão e conectividade na determinação de persistência de interações e composição de metacomunidades. Em teoria, pares de predador-presa com tendência à extinção, por exemplo, podem persistir por meio de uma dinâmica de metacomunidades onde populações locais flutuam assincronicamente. “Long-term persistence of classic metapopulations is essentially due to asynchrony in the dynamics of local populations, which reduces the variance in the intrinsic rate of metapopulation increase and hence reduces the risk of metapopulation extinction” (Hanski, 1998)
O estudo “Persistence of an Extinction-Prone Predator-Prey Interaction Through Metapopulation Dynamics” (Holyoak e P. Lawler, 1996) pode não ter sido o primeiro a mostrar que a estrutura espacial tem a capacidade de contribuir para a persistência de dinâmicas predador-presa, mas foi pioneiro especificamente ao demonstrar claramente a assincronia entre os pedaços de habitat que gera esse padrão. Esse também foi um ponto importante na história da ecologia, mostrando como a baixa dispersão e a conectividade limitada impactam nas dinâmicas entre espécies e composição de comunidades. “[…]no studies have unequivocally demonstrated the asynchrony among patches, low dispersal rates, and rescue effects that prove metapopulation dynamics extend persistence[…]We have demonstrated that spatial subdivision increases the persistence times of Colpidium and Didinium […]” (Holyoak, P. Lawler, 1996)
A Figura 1 demonstra como o experimento foi conduzido, comparando a persistência da dinâmica de predador e presa dos protozoários estudados em 2 tipos de ambientes únicos, isto é, aqueles sem subdivisões, garrafas únicas, e os ambientes subdivididos, formados por garrafas conectadas por um fino canudo, controlando a dispersão dos organismos. Mesmo comparando um habitat único com o mesmo volume total que o de um array (arranjo de garrafas), a dinâmica persistiu por mais tempo no contexto de arrays, metacomunidades. Isso se deu porque a dispersão foi diminuída por uma conectividade limitada.
Figura 1: Arrays
Fonte: Holyoak, P. Lawler (1996)
Apesar de ainda existir um forte debate sobre exatamente como a diversidade de comunidades é afetada por pressão antropogênica (CARDINALE, B. J. et al, 2018) , um consenso está emergindo que o foco deveria estar em estabelecer como a composição de espécies muda com o tempo por escalas espaciais de uma metacomunidade (Chase et al, 2019). Vários conceitos de metacomunidades são considerados na ciência da conservação, mas raramente são considerados simultaneamente (Chase, 2020). Conectividade e dispersão, especificamente em relação à intensidade (conectividade limitada, pouca dispersão ou alta dispersão, conectividade não ou pouco limitada) deveriam ser cuidadosamente analisadas na ótica da conservação. Alguns estudos (Doerr et al 2011, Ryan et al 2012, Berkström 2021), mesmo que nem sempre usando de base a teoria de metacomunidades, já consideram conectividade e dispersão no contexto da conservação . Entretanto, mesmo estes estudos já citados raramente mencionam palavras como metacomunidade ou metapopulação.
É importante ressaltar que a relação entre os fatores nem sempre é óbvia. Mais dispersão e conectividade em um primeiro momento e com menor exposição a esses temas, pode ser interpretado como algo unicamente positivo, que leva a maior biodiversidade. E em certos contextos isso pode ser verdade, como acontece no efeito source-sink para competidores mais fracos (Mouquet, Loreau, 2003). Mas, como visto os textos apresentados ao longo deste ensaio, em conjunto com as aulas durante a matéria, o óbvio raramente constitui uma regra. Estes conteúdos ajudaram a desconstruir alguns conceitos errôneos pré-estabelecidos sobre o funcionamento de comunidades e, por consequência, como a conservação de comunidades pode ser pensada.
The patterns and processes that emerge from the metacommunity level can provide valuable insights in the context of conservation biology, for example,in understanding the abundance and distribution of multiple species (particularly those that are rare and/or declining) in space and time; the degree to which species occupy their available habitat or are dispersal limited; and the biodiversity and compo-sition of species across scales. However, from our ISIWeb of Science search, out of the 1075 papers that used the search term “metacommunit∗OR meta-communit∗,” we found only 145 papers that used this term together with “conservation” in the past 5 years. (Chase et al, 2020)
Quando os conceitos de conectividade e dispersão foram propostos pela primeira vez, a primeira ideia que surgiu foi sobre a falta de conectividade entre manchas de habitat por conta de ações antropogênicas como o desmatamento. Com a gradual exposição a esse tema, foi evidenciando que um habitat fragmentado não se dá apenas por ação antropogênica, tudo depende da escala e dos organismos estudados, a fragmentação pode se dar pela disponibilidade natural de recursos, por exemplo. E isso mostra, portanto, como vários fatores de estruturação de comunidades devem ser levados em conta de maneira não óbvia para depois pensarmos em conservação.
Referências bibliográficas
CARDINALE, B. J. et al. Is local biodiversity declining or not? A summary of the debate over analysis of species richness time trends. Biological Conservation, v. 219, p. 175–183, 1 mar. 2018.
CHASE, J.M., B.J.McGill, P.L. Thompson, et al. Species richness change across spatial scales. Oikos 128: 1079–1091.2019.
CHASE, J. M. et al. Biodiversity conservation through the lens of metacommunity ecology. Annals of the New York Academy of Sciences, v. 1469, n. 1, p. 86–104, 14 maio 2020.
DOERR, V. A. J.; BARRETT, T.; DOERR, E. D. Connectivity, dispersal behaviour and conservation under climate change: a response to Hodgson et al. Journal of Applied Ecology, v. 48, n. 1, p. 143–147, 22 dez. 2010.
HANSKI, Ilkka. Metapopulation dynamics. 1998.
HOLYOAK, M.; LAWLER, S. P. Persistence of an Extinction-Prone Predator-Prey Interaction Through Metapopulation Dynamics. Ecology, v. 77, n. 6, p. 1867–1879, set. 1996.
HOLYOAK, M. Habitat Patch Arrangement and Metapopulation Persistence of Predators and Prey. The American Naturalist, v. 156, n. 4, p. 378–389, out. 2000.
LAWTON, J. H. Are There General Laws in Ecology? Oikos, v. 84, n. 2, p. 177, fev. 1999. HOLYOAK, M.; LAWLER, S. P. Persistence of an Extinction-Prone Predator-Prey Interaction Through Metapopulation Dynamics. Ecology, v. 77, n. 6, p. 1867–1879, set. 1996.
LEIBOLD, M. A. et al. The metacommunity concept: a framework for multi-scale community ecology. Ecology Letters, v. 7, n. 7, p. 601–613, 4 jun. 2004.
LEIBOLD, M. A.; CHASE, J. M. Metacommunity ecology. [s.l.] Princeton, New Jersey, Princeton University Press, 2018.
MOUQUET, N.; LOREAU, M. Community Patterns in Source‐Sink Metacommunities. The American Naturalist, v. 162, n. 5, p. 544–557, nov. 2003.
VELLEND, M. The theory of ecological communities. Princeton: Princeton University Press, 2016.
Efeitos da Dispersão na diversidade de Comunidades e como isso pode se relacionar ao entorno de áreas protegidas
Barbara Lima Silva
Na Ecologia de Comunidades, juntamente com outros processos como deriva, seleção e especiação, a dispersão desempenha um papel significativo na dinâmica e composição das comunidades (Vellend, 2010). Este processo envolve o movimento de organismos no espaço e no tempo (Vellend, 2010),sendo influenciado por uma série de fatores, como densidade populacional (Kreuzinger-Janik et al., 2022), disponibilidade de recursos (Bogoni et al., 2020), predação (Holyoak e Lawler, 1996) e mudanças ambientais (Sugden e Pennisi, 2006). Os movimentos podem ser ativos, como a busca de recursos, ou passivos, como a dispersão de sementes pelo vento (Lowe e McPeek, 2014) podendo ter impactos significativos nas comunidades (Evans et al., 2016; Hubbell, 1979; Ron et al., 2018). Além disso, a dispersão ocorre em várias escalas e é necessário entender os seus efeitos dependendo delas. Em escalas locais, pode impactar diretamente a riqueza e composição das comunidades (Germain et al., 2017; Zha et al., 2016; Cadotte e Fukami, 2005). Já em metacomunidades, o movimento entre diferentes comunidades pode ter efeitos distintos, dependendo da escala temporal e da paisagem (Piano et al., 2023; Cadotte e Fukami, 2005; Grainger e Gilbert, 2016). Em uma escala mais ampla, a dispersão altera a distribuição das espécies em áreas geográficas, assim influenciando a diversidade de um local (Joly et al., 2019; Cadotte e Fukami, 2005).
Dependendo da teoria ecológica, temos diferentes perspectivas sobre o papel da dispersão na formação da estrutura das comunidades. Na Teoria da Biogeografia de Ilhas, a dispersão é vista como um processo que afeta a riqueza e distribuição de espécies em uma determinada área (MacArthur e Wilson, 1967). Por exemplo, há um conjunto de ilhas e, consequentemente, comunidades em cada ilha, assim, à medida que aumenta o isolamento geográfico entre comunidades, a probabilidade de colonização de novos habitats diminui, resultando numa menor riqueza de espécies (De Meester et al., 2005).Já na Teoria Neutra da Biodiversidade, a dispersão é considerada um processo aleatório. Nessa teoria, todos os indivíduos têm a mesma capacidade de se dispersar e colonizar novos habitats (Hubbell, 2001), ou seja, independente de seus atributos e características todos os indivíduos têm a mesma chance de colonizar um local. Essa teoria enfatiza a importância do processo da deriva, a qual afeta taxas de extinção e colonização, e não leva em conta a maior importância dos processos de seleção e competição. Enquanto na Teoria de Metacomunidades, que integra diferentes processos, como dispersão, deriva e seleção. Nessa teoria, a dispersão possui destaque, sendo um dos principais processos que influenciam a composição e dinâmica das comunidades em diferentes escalas (Leibold et al., 2004), mas ao integrar a dispersão com os processos de deriva e seleção, traz diferentes interpretações de como a dispersão pode influenciar os padrões de distribuição e abundância de espécies.
É muito importante entendermos a relação entre a diversidade alfa, beta e gama com a dispersão e suas diferentes escalas, pois essas combinações podem atuar de diversas formas na estruturação das comunidades. Enquanto a diversidade alfa reflete a quantidade de espécies em uma comunidade, a diversidade beta representa a “diferença” na composição de espécies entre as comunidades, e a diversidade gama engloba a diversidade em uma escala regional (Bogoni, 2023; Whittaker 1960). Modelos como o de Mouquet e Loreau (2002) e o de Kneitel e Chase (2004) buscam entender como se dá a relação entre a dispersão e a estrutura das comunidades ecológicas. O primeiro modelo prevê que um nível intermediário de dispersão é ótimo para maximizar a diversidade alfa de metacomunidades na escala local, pois as espécies persistem em manchas de habitat não favoráveis devido a existência de populações-fonte em habitats favoráveis (Mouquet e Loreau, 2002). Outro modelo aponta que se a composição das comunidades difere e que há espécies que apresentam altas taxas de dispersão. A tendência é que a diversidade beta aumente, e a diversidade alfa de cada comunidade se mantenha em baixa (Kneitel e Chase, 2004). Esses modelos ajudam a compreender as relações entre dispersão e diversidade dentro das comunidades e podem ser utilizados na conservação, especialmente em locais de preservação.
A criação de áreas protegidas é uma das principais estratégias de conservação, pois são estabelecidas para proteger a biodiversidade e os ecossistemas (Brancalion et al., 2016). No entanto, considerando que as espécies não permanecem somente nas áreas protegidas se movendo ao longo da paisagem (Paolino et al., 2016), a qualidade do habitat do entorno dessas áreas pode contribuir para a manutenção da diversidade. Assim, há estratégias complementares, como a implementação de Zonas de Amortecimento (ZA) - definidas como o “entorno de uma Unidade de Conservação, onde as atividades humanas estão sujeitas a normas e restrições específicas, com o propósito de minimizar os impactos negativos sobre a unidade” (Brasil, 2000). Contudo, nem todas as áreas protegidas possuem ZA, como é o caso das Áreas de Preservação Permanente (APP) e Reservas Legais. Assim, é importante destacar que a paisagem pode impactar a composição das comunidades, pois desempenha um papel como um filtro ambiental (Henle et al., 2004), e assim influencia nos processos da dispersão (Howes et al., 2023). Por exemplo, as matas ciliares, consideradas como APPs (Brasil, 2012), abrigam rotas de dispersão de espécies (Paolino et al., 2018; Ramos e Anjos, 2014).
Compreender os processos que afetam diversidade em diferentes escalas permite que possamos elaborar estratégias de manejo ecossistêmico, como reforço populacional e reintroduções (Genes et al., 2018), que contribuam para a manutenção da diversidade ao permitir analisar padrões de composição de espécies (Budgno-Pogoda et al., 2021; Chiarucci et al., 2011; Nogueira et al., 2008), inclusive dentro e fora de áreas protegidas. Ao longo de um gradiente de proteção ambiental, há o questionamento sobre como a diversidade pode ser sustentada. Qual o papel da dispersão na manutenção da composição das comunidades ao longo de um gradiente de proteção, tendo em vista o interior e o entorno de áreas protegidas?
Entender como a dispersão contribui para a diversidade em várias escalas e sua relação com áreas de proteção e estratégias de conservação é fundamental para criar estratégias eficazes de conservação. Ron e colaboradores (2018) realizaram um estudo por meio de modelagem que demonstra que a dispersão pode aumentar o tamanho efetivo das comunidades ao aumentar a ocorrência das espécies em diferentes localidades, e isso, consequentemente, pode aumentar a força de outros processos influenciando na composição das comunidades. Ao incluirmos as características da paisagem na relação entre dispersão e diversidade, é demonstrado por Pônzio et al. (2023) que a quantidade de cobertura vegetal nativa tem efeitos positivos na riqueza de espécies. Assim, a tendência é que a diversidade alfa em áreas protegidas seja maior que em seu entorno (Gray et al., 2016), contudo a diversidade alfa é maior no entorno da área protegida na Floresta Estadual de Cajuru (Pônzio et al., 2022). Esse cenário contra intuitivo pode estar na paisagem do entorno da área protegida, de forma que isso pode favorecer a dispersão das espécies alterando os valores de diversidade beta entre os locais. Quando consideramos a influência das áreas protegidas, a relação entre dispersão e diversidade pode ser complexa, especialmente ao depender da paisagem. Portanto, para contribuir com a formulação de estratégias de conservação mais eficazes, é necessário que os estudos busquem compreender essa relação e acrescente variáveis relacionadas à dispersão, visto que essa possui um papel relevante na manutenção da biodiversidade e na integridade das comunidades.
Referências bibliográficas
Bogoni, J. 2023. The analytic progress on biodiversity measures. Brazilian Journal Of Mammalogy 92: e92202395.
Bogoni, J. A., Muniz-Tagliari, M., Peroni, N., Peres, C. A. 2020. Testing the keystone plant resource role of a flagship subtropical tree species (Araucaria angustifolia) in the Brazilian Atlantic Forest. Ecological Indicators 118: e106778.
Brancalion, P. H. S., Garcia, L. C., Loyola, R., Rodrigues, R. R., Pillar, V. D., Lewinsohn, T. M. 2016. A critical analysis of the Native Vegetation Protection Law of Brazil (2012): updates and ongoing initiatives. Natureza & Conservação 14: 1–15.
Brasil. Lei Nº 12.651, de 25 de maio de 2012. Dispõe sobre a proteção da vegetação nativa; altera as Leis nºs 6.938, de 31 de agosto de 1981, 9.393, de 19 de dezembro de 1996, e 11.428, de 22 de dezembro de 2006; revoga as Leis nºs 4.771, de 15 de setembro de 1965, e 7.754, de 14 de abril de 1989, e a Medida Provisória nº 2.166-67, de 24 de agosto de 2001; e dá outras providências. Brasil, 2012.
Bugno-Pogoda, A., Durak, R., Durak, T. 2021 Impact of Forest Management on the Temporal Dynamics of Herbaceous Plant Diversity in the Carpathian Beech Forests over 40 Years. Biology 10(5): 406.
Cadotte, M. W., Fukami, T. 2005. Dispersal, spatial scale, and species diversity in a hierarchically structured experimental landscape. Ecology Letters 8(5):548-557.
Chiarucci, A., Bacaro, G., Scheiner, S. M. 2011. Old and new challenges in using species diversity for assessing biodiversity. Philosophical Transactions Of The Royal Society B: Biological Sciences 366(1576): 2426-2437.
De Meester, L., Declerck, S., Stoks, R., Louette, G., Van De Meutter, F., De Bie, T., Michels, E., Brendonck, L. 2005. Ponds and pools as model systems in conservation biology, ecology and evolutionary biology. Aquatic Conservation Marine and Freshwater Ecosystems 15:715-725.
Evans, S., Martiny, J. B H, Allison, S. D. 2016. Effects of dispersal and selection on stochastic assembly in microbial communities. The Isme Journal 11(1): 176-185.
Genes, L., Fernandez, F. A. S., Vaz‐De‐Mello, F. Z., Rosa, P. D., Fernandez, E., Pires, A. S. 2018. Effects of howler monkey reintroduction on ecological interactions and processes. Conservation Biology 33(1): 88-98.
Germain, R. M., Strauss, S. Y., Gilbert, B. 2017. Experimental dispersal reveals characteristic scales of biodiversity in a natural landscape. Proceedings of the National Academy of Sciences 114(17): 4447-4452.
Grainger, T. N., Gilbert, B. 2016. Dispersal and diversity in experimental metacommunities: linking theory and practice. Oikos 125(9): 1213-1223.
Gray, C. L., Hill, S. L. L., Newbold, T., Hudson, L. N., Börger, L., Contu, S., Hoskins, A. J., Ferrier, S., Purvis, A., Scharlemann, J. P. W. 2016. Local biodiversity is higher inside than outside terrestrial protected areas worldwide. Nature Communications 7(1).
Henle, K., Davies, K. F., Kleyer, M., Margules, C., Settele, J. 2004. Predictors of species sensitivity to fragmentation. Biodiversity and Conservation. Biodiversity & Conservation 13:207-251.
Holyoak, M., Lawler, S. P. 1996. Persistence of an Extinction‐Prone Predator‐Prey Interaction Through Metapopulation Dynamics. Ecology 77(6): 1867-1879.
Howes, B., González-Suárez, M., Jensen, H. J., Anjos, L., Develey, P. F., Hatfield, J. H., Morante-Filho, J. C., Uezu, A., Banks-Leite, C. 2023. Deforestation alters species interactions. Natural Sciences 3(2): 1-12.
Hubbell, S. P. 1979. Tree Dispersion, Abundance, and Diversity in a Tropical Dry Forest. Science 203(4387): 1299-1309.
Hubbell, S. P. 2001. The unified theory of biodiversity and biogeography. Princeton University Press, New Jersey. 396p
Joly, K., Gurarie, E., Sorum, M. S., Kaczensky, P., Cameron, M. D., Jakes, A. F., Borg, B. L., Nandintsetseg, D., Hopcraft, J. G. C., Buuveibaatar, B. 2019. Longest terrestrial migrations and movements around the world. Scientific Reports 9(1): 1-10.
Kneitel, J. M., Chase, J. M. 2003. Trade‐offs in community ecology: linking spatial scales and species coexistence. Ecology Letters 7(1): 69-80.
Lowe, W. H., McPeek, M. A. 2014. Is dispersal neutral? Trends in Ecology & Evolution 29: 444–450.
Kreuzinger-Janik, B., Gansfort, B., Ptatscheck, C. 2022. Population density, bottom-up and top-down control as an interactive triplet to trigger dispersal. Scientific Reports 12: 5578
Leibold, M. A., Holyoak, M., Mouquet, N., Amarasekare, P., Chase, J. M., Hoopes, M. F., Holt, R. D., Shurin, J. B., Law, R., Tilman, D., Loreau, M. 2004. The metacommunity concept: a framework for multi-scale community ecology. Ecology Letter, 7: 601-613.
MacArthur, R. H., Wilson, E. O. 1967. The Theory of Island Biogeography. Princeton University Press.
Mouquet, N., Loreau, M. 2002. Coexistence in metacommunities: the regional similarity hypothesis. The American Naturalist 159: 420–426.
Nogueira, I. de S., Nabout, J. C., Oliveira, J. E., Silva, K. D. 2008. Diversidade (alfa, beta e gama) da comunidade fitoplanctônica de quatro lagos artificiais urbanos do município de Goiânia, GO. Hoehnea 35(2): 219-233.
Paolino, R. M., Versiani, N. F., Pasqualotto, N., Rodrigues, T. F., Krepschi, V. G., Chiarello, A. G. 2016. Buffer zone use by mammals in a Cerrado protected area. Biota Neotropica 16(2).
Paolino, R. M., Royle, J. A., Versiani, N. F., Rodrigues, T. F., Pasqualotto, N., Krepschi, V. G., Chiarello, A. G. 2018. Importance of riparian forest corridors for the ocelot in agricultural landscapes. Journal of Mammalogy 99(4): 874–884.
Piano, E., Bonte, D., Meester, L., Hendrickx, F. 2023. Dispersal capacity underlies scale‐dependent changes in species richness patterns under human disturbance. Ecology 104(3): 1-13.
Pônzio, M., Alberici, V., Pasqualotto, N., Paolino, R., Rodrigues, T., Chiarello, A. 2022. Mammals of Cajuru State Forest and surroundings: a neglected but important Protected Area for the Cerrado conservation in the São Paulo state, Brazil. Biota Neotropica 22(1).
Ramos, C. C. O., Anjos, L. 2014. The width and biotic integrity of riparian forests affect richness, abundance, and composition of bird communities. Natureza & Conservação 12(1): 59-64.
Ron, R., Fragman-Sapir, O., Kadmon, R. 2018. Dispersal increases ecological selection by increasing effective community size. Proceedings Of The National Academy Of Sciences 115(44): 11280-11285.
Sugden, A., Pennisi, E. 2006. When to Go, Where to Stop. Science 313(5788): 775-775.
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quartely Review of Biology 85, 183–206.
Whittaker, R. H. 1960. Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs 30: 280–338.
Zha, Y., Berga, M., Comte, J., Langenheder, S. 2016. Effects of Dispersal and Initial Diversity on the Composition and Functional Performance of Bacterial Communities. Plos One 11(5): e155239.
Como os trade-offs ajudam a estruturar comunidades e qual é sua possível relação com a macroevolução?
Meari Caldeira
Trade-off, ou demanda conflitante, é o nome dado para a situação em que uma espécie é beneficiada por uma novidade evolutiva, mas esse benefício vem acompanhado de um prejuízo para a mesma espécie quando associado a outro caractere ou contexto (Stearns 2014). Em outras palavras, é o custo que a espécie deve pagar quando uma característica benéfica no contexto em que se insere está ligada a outra, que é desvantajosa (Futuyma & Moreno 1988; Stearns 1989), ou seja, um comprometimento de uma característica quando existem melhorias em outra (Begon et al. 2007; Roff & Fairbairn 2007; Garland Jr. 2014). Um exemplo são os trade-offs de história de vida, aqueles relacionados diretamente com taxas de reprodução ou crescimento de uma espécie. Um deles é o custo da reprodução, que representa a noção de que, ao alocar recursos para o processo de deixar descendentes e cuidar deles, os indivíduos de uma espécie acabam reduzindo sua chance de sobrevivência ou taxa de crescimento corporal, o que resulta em menores taxas de reprodução no futuro (Begon et al. 2007; Wikelski 2009). Nem todo trade-off é ligado à reprodução ou ao futuro, no entanto; em plantas, é comum que haja trade-offs de caráter constitutivo, os chamados trade-offs de alocação, que dizem respeito à forma como os recursos serão distribuídos dentro do próprio indivíduo após sua aquisição. Por exemplo, folhas são responsáveis pela fotossíntese, portanto, mais folhas significam maior disponibilidade de energia para a planta; contudo, a construção e a manutenção do tecido foliar demandam muita energia, constituindo um trade-off de alocação para a planta (Ackerly & Stuart 2009).
Um trade-off é resultado de interações entre efeitos genéticos (como epistasia, pleiotropia e ligações gênicas) e fisiológicos (como alças de feedback hormonal e alocações de energia) com o fenótipo da espécie e o contexto em que ela está inserida (Futuyma 2005; Stearns 2014; Stearns 1989), e pode envolver, inclusive, interações com outros organismos (Farahpour et al. 2018), uma vez que as características afetadas por ele podem aumentar a chance de a espécie ser predada (Futuyma 2005) ou diminuir sua capacidade competitiva (Farahpour et al. 2018), por exemplo.
Embora sejam considerados pervasivos na natureza (Schiesari 2024; Wikelski 2009) e esperados, dado que são raros os casos em que as novidades evolutivas não geram custos e a seleção natural parece limitada somente por fatores históricos ou intrínsecos, como o plano corpóreo da espécie e seu comportamento (Wikelski 2009; Stearns 1989), é difícil mensurar os trade-offs, ou mesmo detectar sua existência (Begon et al. 2007; Futuyma 2005). Se existe uma associação negativa entre dois caracteres, mas o benefício conferido por um deles ao crescimento e ao fitness é muito superior ao prejuízo causado pelo decréscimo do outro caractere, então não é exagero pensar que toda a população ou até mesmo espécie se aproxime desse ótimo reprodutivo, e não haja mais variações nos caracteres que compõem o trade-off; diz-se, então, que o trade-off foi fixado (Begon et al. 2007; Roff & Fairbairn 2007), e não é mais possível observá-lo. Outro caso de difícil detecção é quando o custo da reprodução é subvertido por uma variação geneticamente codificada na quantidade de recursos que os indivíduos conseguem adquirir do ambiente, fazendo com que a associação entre reprodução e sobrevivência seja positiva (Futuyma 2005; Begon 2007). Além disso, um pressuposto importante para a existência dos trade-offs é que as espécies possuem mecanismos para aferir e perceber benefícios relacionados ao fitness que determinadas características e comportamentos lhes conferem; a partir do momento em que essa percepção muda, a relação entre as características analisadas, que antes era negativa, também pode mudar, tornando-se neutra ou até mesmo positiva (Stearns 1989; Hutchings et al. 2006; Farahpour et al. 2018), o que pode acarretar mudanças também nas interações que essa espécie estabelece com outras e com o ambiente (Farahpour et al. 2018).
As desvantagens que os trade-offs impõem sobre as espécies impedem que elas se aproveitem completamente das vantagens que possuem sobre outras espécies no ambiente (Chesson 2000); portanto, as espécies funcionam sob a máxima do “quem sabe um pouco de tudo, não sabe muito de nada” (Wikelski 2009), e precisam escolher qual caractere favorecer, especializando-se nele (Hutchings et al. 2006). Daí derivam padrões como as estratégias k e r, respostas ao trade-off entre a energia aportada para a produção de gametas e a sobrevivência da prole (Begon et al. 2007); esse tipo de estratégia pode estar representado, inclusive, por número da prole versus tipo e/ou qualidade de estratégia de defesa contra predadores, ou quantidade de descendentes versus capacidade competitiva da espécie (Hutchings et al. 2006; Farahpour et al. 2018).
Trade-offs relacionados à dieta também envolvem interações ecológicas, dado que a alimentação, em si, já representa uma dessas interações. Um deles é muito conhecido: o trade-off de eficiência de captura de presas por predadores carnívoros, que devem “escolher” entre ativamente buscar e capturar suas vítimas, o que gasta muita energia, mas pode ser mais eficiente, ou simplesmente esperar por elas, o que não gasta energia e também pode ser eficiente se houver uma quantidade suficiente de potenciais vítimas, mas pode também fazer o indivíduo morrer de fome se não houver (Begon et al. 2007; Brown 2009). Esse trade-off é parecido com outro, muito simples de explicar: o de evitação de parasitas associados ao alimento. Considere uma população de mamíferos herbívoros. Ao encontrar uma mancha na qual há patógenos, os animais podem escolher pastar nela e arriscar pegar a doença que está presente ali ou gastar uma quantidade maior de energia para encontrar outra mancha, na qual os patógenos estejam ausentes (Hutchings et al. 2006). Uma vez que já se encontram vitimizados pelo patógeno, os herbívoros precisam novamente tomar a decisão entre priorizar a eficiência energética ou uma dieta rica em nitrogênio, que auxilia na resistência contra o parasita (Hutchings et al. 2006). No entanto, provavelmente o mais importante trade-off relacionado à dieta é aquele entre especialização e generalização. Espécies especialistas podem explorar com muita qualidade os recursos, no entanto, precisam se restringir a manchas onde o recurso que exploram ocorre ou despender maior energia para encontrá-lo (Begon et al. 2007); já os generalistas, embora possuam mais recursos à sua disposição, podem não o fazer com a mesma eficiência (embora isso seja debatível; sob determinadas condições, é possível que o façam, inclusive excluindo competitivamente os especialistas) (Futuyma & Moreno 1988).
É inegável que os trade-offs exercem um papel indispensável na manutenção da coexistência entre as espécies (Chesson 2000; Vellend 2010). Por exemplo, em uma condição na qual os distúrbios variam com o tempo e o espaço, uma espécie r-estrategista pode ter muito sucesso inicialmente, mas ser suplantada por uma espécie k-estrategista (Begon et al. 2007; Vellend 2016), que é melhor competidora. Dessa forma, as espécies piores competidoras, mas melhores dispersoras, persistem espaçotemporalmente, o que significa que os trade-offs baseados em dispersão promovem a coexistência entre as espécies (Vellend 2010; Vellend 2016). Nesse mesmo exemplo, e também nos diversos outros citados até agora, está incutida também a ideia de que a seleção e os trade-offs possuem uma relação bastante íntima: a necessidade de exploração diferencial dos recursos não ocorre sem prejuízo a outras características, principalmente eficiência energética (Futuyma & Moreno 1988), caracterizando, portanto, relações de trade-off (Vellend 2016). Em outros momentos, contudo, os trade-offs podem ajudar as comunidades a manter a coexistência entre espécies apesar de haver uma seleção local espacialmente homogênea, caso haja relação negativa entre a capacidade de dispersão e o quanto as espécies estão adaptadas à situação imposta pela seleção naquele contexto (Vellend 2016). Tendo em mente o apresentado até aqui, então, não é estranho dizer que os trade-offs promovem coexistência entre espécies e ajudam a definir a estrutura das comunidades.
A macroevolução é uma disciplina que, segundo Futuyma (2015), “seria útil de definir, mas cujas definições variam”. Ela foi apresentada em 1927 como a evolução de táxons superiores a espécies (Futuyma 2005; Hautmann 2019); posteriormente, em 1937, Dobzhansky incutiu na definição o componente temporal, resumindo a macroevolução como a evolução em grandes escalas de tempo (Hautmann 2019); mais recentemente, outros autores passaram a defini-la como “a evolução guiada pela seleção da variação interespecífica” (Futuyma 2005; Hautmann 2019). A macroevolução lida, portanto, com a variação entre espécies e a velocidade com que as mudanças ocorrem nessa escala. É comum, portanto, que biólogos macroevolutivos se expressem em termos de taxas de especiação, extinção, diversificação (que é a subtração entre as anteriores) e evolução de caracteres (Futuyma 2005).
Muito embora esteja relacionado à evolução de caracteres e ajude a definir a estrutura das comunidades, como já citado, não é claro como o conceito de trade-offs está associado à macroevolução. Se situações como a seleção do modo de vida generalista ou especialista estão relacionados a trade-offs, podendo acarretar aumento (quando há particionamento de nicho) ou diminuição do número de espécies (quando há exclusão competitiva) (Futuyma & Moreno 1988), então também não seria um grande salto pensar que trade-offs afetam as taxas de especiação e extinção, e, por conseguinte, de diversificação. Existem evidências disso: larvas de lepidópteros podem ocorrer em angiospermas ou coníferas, mas não nas duas ao mesmo tempo, favorecendo a especiação e aumentando, assim, suas taxas (Peterson et al. 2016). Em aves, a onivoria é desfavorecida ao longo da evolução devido a competição entre e dentro de diferentes guildas alimentares, o que faz com que as taxas de diversificação de aves onívoras sejam baixas relativamente às de outras guildas (Burin et al. 2016). Também há, contudo, evidências do contrário. Em Asclepias spp., foi encontrado um trade-off limitando a evolução de defesas – e, portanto, afetando a sobrevivência – dentro das espécies, mas não entre elas (Agrawal & Hastings 2019), o que sugere que pelo menos alguns trade-offs estejam restritos à escala microevolutiva. Uma vez que as relações conceituais entre micro- e macroevolução não estão completamente elucidadas (Rolland et al. 2023), é difícil dizer com certeza se tudo que acontece em escala microevolutiva pode ser transposto para a escala macroevolutiva, e como. Dessa forma, embora sejam importantes para a estruturação das comunidades e para a teoria ecológica, teremos que aguardar para ter uma hipótese mais geral sobre como os trade-offs se comportam na escala macroevolutiva, se é que essa hipótese é possível.
Referências bibliográficas
Ackerly, D. D., & Stuart, S. A. (2009). Physiological Ecology: Plants. In: S. A. Levin, S. R. Carpenter, H. C. J. Godfray, A. P. Kinzig, M. Loreau, & J. B. Losos (Eds.), The Princeton Guide to Ecology (pp. 20–26). Princeton University Press. https://doi.org/10.1515/9781400833023
Agrawal, A. A., & Hastings, A. P. (2019). Trade‐offs constrain the evolution of an inducible defense within but not between plant species. Ecology, 100(12). https://doi.org/10.1002/ecy.2857
Begon, M., Townsend, C. R., & Harper, J. L. (2007). Ecologia: de Indivíduos a Ecossistemas (4th ed.). Artmed.
Brown, J. S. (2009). Foraging Behavior. In: S. A. Levin, S. R. Carpenter, H. C. J. Godfray, A. P. Kinzig, M. Loreau, & J. B. Losos (Eds.), The Princeton Guide to Ecology (pp. 53–58). Princeton University Press. https://doi.org/10.1515/9781400833023
Burin, G., Kissling, W. D., Guimarães, P. R., Şekercioğlu, Ç. H., & Quental, T. B. (2016). Omnivory in birds is a macroevolutionary sink. Nature Communications, 7(1). https://doi.org/10.1038/ncomms11250
Chesson, P. (2000). Mechanisms of maintenance of species diversity. Annual Review of Ecology and Systematics, 31(1), 343–366. https://doi.org/10.1146/annurev.ecolsys.31.1.343
Farahpour, F., Saeedghalati, M., Brauer, V. S., & Hoffmann, D. (2018). Trade-off shapes diversity in eco-evolutionary dynamics. eLife, 7. https://doi.org/10.7554/elife.36273
Futuyma, D. J., & Moreno, G. (1988). The evolution of ecological specialization. Annual Review of Ecology and Systematics, 19(1), 207–233. https://doi.org/10.1146/annurev.es.19.110188.001231
Futuyma, D. J. (2005). Evolution (3rd ed.). Sinauer Associates, Inc.
Futuyma, D. J. (2015). Can modern evolutionary theory explain macroevolution? 29–85. In: Serelli, E. Gontier, N. (eds). Macroevolution. Springer, 403 pp.
Garland Jr., T. (2014) Quick guide: Trade-offs. Current Biology, 24(2), 60-61. https://doi.org/10.1016/j.cub.2013.11.036
Hautmann, M. (2019). What is macroevolution? Palaeontology, 63(1), 1–11. https://doi.org/10.1111/pala.12465
Hutchings, M. R., Judge, J., Gordon, I. J., Athanasiadou, S., & Kyriazakis, Ι. (2006). Use of trade‐off theory to advance understanding of herbivore–parasite interactions. Mammal Review, 36(1), 1–16. https://doi.org/10.1111/j.1365-2907.2006.00080.x
Peterson, D. A., Hardy, N. B., & Normark, B. B. (2016). Micro- and macroevolutionary Trade-Offs in Plant-Feeding insects. The American Naturalist, 188(6), 640–650. https://doi.org/10.1086/688764
Roff, D. A., & Fairbairn, D. J. (2006). The evolution of trade‐offs: where are we? Journal of Evolutionary Biology, 20(2), 433–447. https://doi.org/10.1111/j.1420-9101.2006.01255.x
Rolland, J., Henao‐Díaz, L. F., Doebeli, M., Germain, R. M., Harmon, L. J., Knowles, L. L., Liow, L. H., Mank, J. E., Macháč, A., Otto, S. P., Pennell, M. W., Salamin, N., Silvestro, D., Sugawara, M., Uyeda, J. C., Wagner, C. E., & Schluter, D. (2023). Conceptual and empirical bridges between micro- and macroevolution. Nature Ecology and Evolution, 7(8), 1181–1193. https://doi.org/10.1038/s41559-023-02116-7
Schiesari, L. C. (2024). In: Ecologia de Comunidades (disciplina de pós-graduação).
Stearns, S. C. (2014). Natural Selection, Adaptation, and Fitness: Overview. In: J. B. Losos, D. A. Baum, D. J. Futuyma, H. E. Hoekstra, R. E. Lenski, & A. J. Moore (Eds.), The Princeton Guide to Evolution (pp. 193–199). Princeton University Press. https://doi.org/10.1515/9781400848065
Stearns, S. C. (1989). Trade-Offs in Life-History Evolution. Functional Ecology, 3(3), 259. https://doi.org/10.2307/2389364
Vellend, M. (2010). Conceptual synthesis in community ecology. The Quarterly Review of Biology, 85(2), 183–206. https://doi.org/10.1086/652373
Vellend, M. (2016). The Theory of Ecological Communities (MPB-57). Princeton University Press eBooks. https://doi.org/10.1515/9781400883790
Wikelski, M. (2009). Physiological Ecology: Animals. In S. A. Levin, S. R. Carpenter, H. C. J. Godfray, A. P. Kinzig, M. Loreau, & J. B. Losos (Eds.), The Princeton Guide to Ecology (pp. 14–19). Princeton University Press. https://doi.org/10.1515/9781400833023
Metacomunidades e a Relação Patógeno-Hospedeiro: Explorando a Interação Complexa na Ecologia
Beatriz Alonso
Metacomunidades na ecologia referem-se a conjuntos de comunidades locais interconectadas por meio da dispersão de espécies e interações bióticas (Wilson, 1992; Holyoak & Mata, 2008). Em outras palavras, são redes de habitats que se influenciam mutuamente através do movimento de organismos entre eles, resultando em padrões complexos de distribuição e dinâmica das espécies. Para essa teoria, a escala (local ou regional) tem grande importância, uma vez que está intrinsecamente relacionada com o processo de dispersão (Leibold, 2009). De acordo com Vellend (2016), a dispersão é o movimento de organismos de um local para outro envolvendo diversas localidades, sendo fatores importantes para a dinâmica e estrutura das comunidades. Esses sistemas permitem entender como diferentes ambientes estão ligados e como as interações entre as espécies podem variar ao longo desses ambientes, desempenhando um papel crucial na manutenção da biodiversidade e na resposta dos ecossistemas às mudanças ambientais (Logue et al., 2011).
Baseada na teoria de Biodiversidade de Ilhas de MacArthur e Wilson (1697), a qual tenta explicar a relação espécie-área, propondo que a riqueza de uma ilha é produto dos processos de colonização e extinção, resultando no ganho e/ou perda de espécies de acordo com o isolamento dessa ilha (MacArthur & Wilson, 1967), a teoria de metacomunidades surgiu a partir da necessidade de se explicar a dispersão em escalas locais com fluxo contínuo de espécies (Leibold et al., 2004) e conta com quatro paradigmas: seleção de espécies (do inglês “species sorting”), efeito de massa (do inglês, “mass effect”), dinâmica neutra (do inglês, “neutral model”) e dinâmica de manchas (do inglês, “patch dynamics”) (Leibold, 2009; Leibold et al., 2004; Logue et al., 2011), cada um unindo a dispersão aos processos de deriva, especiação e seleção.
O paradigma de seleção de espécies enfatiza que os gradientes de recursos ou os tipos de manchas provocam diferenças na demografia local e interação entre espécies locais, afetando sua composição (Leibold et al., 2004). Já o paradigma de efeito de massa destaca que a dinâmica espacial pode ter efeitos na densidade populacional local, baseando-se no efeito da imigração e emigração na dinâmica de uma população local (Leibold et al., 2004). Ambos levam em consideração a heterogeneidade das manchas de habitat e espécies de diferentes nichos (Mittelbach & McGill, 2019). No paradigma de dinâmica neutra, assume-se que todas as espécies estão presentes em um mesmo nicho e possuem competências semelhantes (Hubbell, 2001; Leibold et al., 2004; Mittelbach & McGill, 2019). Por fim, o paradigma de dinâmica de manchas adota uma perspectiva de que as machas de habitat são idênticas e que podem estar ocupadas ou desocupadas por espécies cuja diversidade é limitada pela dispersão (Leibold et al., 2004). Ambos levam em consideração a homogeneidade das manchas de habitat (Mittelbach & McGill, 2019).
Estudos de metacomunidades podem ser aplicados a diversas áreas da ecologia e foram essenciais para o entendimento das dinâmicas populacionais (Leibold & Chase, 2016; Patrick et al., 2021; Vellend, 2016; Wilson, 1992). Uma área pouco explorada em metacomunidades é a da relação patógeno-hospedeiro. Contudo, estudos mostram que é possível relacionar estudos dessa área com microrganismos. (Lima, 2016; Martiny et al., 2006) De fato, um trabalho avaliando a helmintofauna e a estrutura de metacomunidades de oito roedores da Mata Atlântica do Rio de Janeiro revelou que existe um padrão aleatório para a relação patógeno-hospdeiro, de modo que cada espécie de helminto tem uma resposta diferente ao gradiente ambiental (Cardoso et al., 2018). Além disso, outro estudo demonstrou que o estudo as condições ambientais podem ser um fator de influência importante na metacomunidade dos hemosporídeos aviários (representados pelos gêneros Plasmodium, Haemoproteus and Leucocytozoon) do que as características relacionadas aos seus hospedeiros (Álvarez-Mendizábal et al., 2021). Já em estudo com parasitos de peixes, foi visto que a estrutura das metacomunidades dos parasitas das áreas de inundação de rios no Paraná depende do estágio de infecção desses parasitas (Costa et al., 2021).
A relação entre patógenos e hospedeiros é complexa e dinâmica, influenciada por uma série de fatores, incluindo a dispersão de organismos, a suscetibilidade do hospedeiro e a capacidade de adaptação do patógeno. Em metacomunidades, essa relação se torna ainda mais intrincada devido à conectividade entre as comunidades e à possibilidade de transmissão de patógenos entre diferentes populações hospedeiras no processo de dispersão. Utilizar essa teoria em pesquisas sobre a relação entre organismos causadores de doenças e seus hospedeiros pode auxiliar na descoberta e compreensão de fenômenos ecológicos que influenciam a composição das comunidades de parasitas dentro e entre diferentes comunidades de hospedeiros (Álvarez-Mendizábal et al., 2021).
Devido a sua capacidade de parasitar diversos vertebrados terrestres ao redor de todo o mundo (Barker, Murrell, 2004; Keiran, Durden, 2005), os carrapatos são considerados um dos principais grupos de vetores de doenças infecciosas para humanos (Socolovschi et al., 2009). Entre essas doenças, está a febre maculosa branda, cujo agente etiológico é a bactéria Rickettsia parkeri. Estudos recentes demonstraram que existe uma diferença quanto à prevalência da bactéria R. parkeri, entre os carrapatos dos litorais de São Paulo, sendo no litoral norte mais prevalente do que no litoral sul (de Albuquerque, 2021; Takeda, 2022). No meu atual estudo, meu objetivo é avaliar a composição metagenômica da microbiota do carrapato Amblyomma ovale, vetor da bactéria, coletados em duas localidades distintas dos litorais norte e sul de São Paulo, e buscar entender o porquê dessa diferença. Pensando do ponto de vista ecológico, meu interesse da relação patógeno-hospedeiro com metacomunidades é entender que outros processos podem estar envolvidos nessa diferença de prevalência da bactéria (e consequentemente sua transmissão). Para isso, seria interessante pensar primeiramente na escala do estudo. Como o foco é a relação entre o patatógeno (R. parkeri) e o hospedeiro (A. ovale), pensar numa escala local seria pensar na área de coleta (os bairros, por exemplo); já para a escala regional, poderia ser pensada nas cidades onde foram realizadas as coletas.
Outro fator a pode ser considerado do ponto de vista ecológico, é o processo de dispersão que esses carrapatos vetores podem sofrer entre os litorais. A dispersão pode acontecer tanto através de cachorros “regionais” (transição dentro da mesma cidade) quanto por cachorros “locais” (transição dentro dos bairros) de cada litoral, além de, claro, cachorros que vêm de outras cidades e até mesmo estados, principalmente durante viagens. Esse processo pode aumentar a diversidade através da imigração numa escala local, e pode ser capaz de homogeneizar sua composição numa escala regional (Vellend, 2016).
Referências Bibliográficas
de Albuquerque, M. P. Caracterização filogenética de cepas Rickettsia parkeri em carrapatos e sua dispersão em áreas endêmicas do Estado de São Paulo. São Paulo: [s. n.], 2021.
Álvarez-Mendizábal, P., Villalobos, F., Rodríguez-Hernández, K., Hernández-Lara, C., Rico-Chávez, O., Suzán, G., Chapa-Vargas, L., & Santiago-Alarcon, D. (2021). Metacommunity structure reveals that temperature affects the landscape compositional patterns of avian malaria and related haemosporidian parasites across elevations. Acta Oecologica, 113. https://doi.org/10.1016/j.actao.2021.103789
Barker, S. C.; murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitology, vol. 129, no SUPPL., 2004. https://doi.org/10.1017/S0031182004005207.
Cardoso, T. D. S., Braga, C. A. de C., Macabu, C. E., Simões, R. de O., da Costa-Neto, S. F., Maldonado Júnior, A., Gentile, R., & Luque, J. L. (2018). Helminth metacommunity structure of wild rodents in a preserved area of the atlantic forest, Southeast Brazil. Revista Brasileira de Parasitologia Veterinaria, 27(4), 495–504. https://doi.org/10.1590/s1984-296120180066
Costa, A. P. L., Takemoto, R. M., Lizama, M. de los A. P., & Padial, A. A. (2021). Metacommunity of a host metapopulation: explaining patterns and structures of a fish parasite metacommunity in a Neotropical floodplain basin. Hydrobiologia, 848(21), 5103–5118. https://doi.org/10.1007/s10750-021-04695-7
Holyoak, and Mata T M. Metacommunities. In Sven Erik Jørgensen and Brian D. Fath (Editor-in-Chief), General Ecology. Vol. [3] of Encyclopedia of Ecology, 5 vols. pp. [2313-2318] Oxford: Elsevier Hubbell S. P. 2001. The Unified Neutral Theory of Biogeography and Biodiversity. Princeton (NJ): Princeton University Press
Keirans, J.E. and Durden, L.A. (2005). Tick Systematics and Identification. In Tick-Borne Diseases of Humans (eds J.L. Goodman, D.T. Dennis and D.E. Sonenshine). https://doi.org/10.1128/9781555816490.ch7
Leibold, M. A.. “III.8 Spatial and Metacommunity Dynamics in Biodiversity”. The Princeton Guide to Ecology, edited by Simon A. Levin, Stephen R. Carpenter, H. Charles J. Godfray, Ann P. Kinzig, Michel Loreau, Jonathan B. Losos, Brian Walker and David S. Wilcove, Princeton: Princeton University Press, 2009, pp. 312-319. https://doi.org/10.1515/9781400833023.312
Leibold, M. A., & Chase, J. M. Metacommunity Ecology. Princeton University Press, 2016, Capítulo 1, pp 1-22 (Volume 59).
Leibold, M. A., Holyoak, M., Mouquet, N., Amarasekare, P., Chase, J. M., Hoopes, M. F., Holt, R. D., Shurin, J. B., Law, R., Tilman, D., Loreau, M., & Gonzalez, A. (2004). The metacommunity concept: A framework for multi-scale community ecology. Em Ecology Letters (Vol. 7, Número 7, p. 601–613). https://doi.org/10.1111/j.1461-0248.2004.00608.x
Lima, M. S. (2016). Dinâmica da comunidade microbiana entre múltiplas escalas espaciais e temporais em lagos rasos costeiros do extremo sul do Brasil [Tese]. Universidade Federal do Rio Grande do Sul.
Logue, J. B., Mouquet, N., Peter, H., & Hillebrand, H. (2011). Empirical approaches to metacommunities: A review and comparison with theory. Em Trends in Ecology and Evolution (Vol. 26, Número 9, p. 482–491). https://doi.org/10.1016/j.tree.2011.04.009
MacArthur R. H., Wilson E. O. 1967. The Theory of Island Biogeography. Princeton (NJ): Princeton University Press
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., Horner-Devine, M. C., Kane, M., Krumins, J. A., Kuske, C. R., Morin, P. J., Naeem, S., Øvreås, L., Reysenbach, A. L., Smith, V. H., & Staley, J. T. (2006). Microbial biogeography: Putting microorganisms on the map. Em Nature Reviews Microbiology (Vol. 4, Número 2, p. 102–112). https://doi.org/10.1038/nrmicro1341
Mittelbach, G. G., & McGill, B. J. (2019). Community Ecology. Em Community Ecology. Oxford University Press. https://doi.org/10.1093/oso/9780198835851.001.0001
Patrick, C. J., Anderson, K. E., Brown, B. L., Hawkins, C. P., Metcalfe, A., Saffarinia, P., Siqueira, T., Swan, C. M., Tonkin, J. D., & Yuan, L. L. (2021). The application of metacommunity theory to the management of riverine ecosystems. Em Wiley Interdisciplinary Reviews: Water (Vol. 8, Número 6). John Wiley and Sons Inc. https://doi.org/10.1002/wat2.1557
Socolovschi, C.; mediannikov, O.; raoult, D.; Parola, P. The relationship between spotted fever group rickettsiae and ixodid ticks. Veterinary Research, vol. 40, no 2, 2009. https://doi.org/10.1051/vetres/2009017
Takeda, G. A. C. G. Avaliação soroepidemiológica de cães expostos a Rickettsia parkeri e correlação com a estrutura da paisagem no litoral do estado de São Paulo. São Paulo: [s. n.], 2022.
Vellend, M. (2016). The Theory of Ecological Communities. Princeton University Press, 2016. Capítulo 9, pp 138-157 (Volume 57).
Wilson, D. S. (1992). Complex Interactions in Metacommunities, with Implications for Biodiversity and Higher Levels of Selection (Vol. 73, Número 6).
Efeitos não letais da predação, modulação comportamental
Ana Maria de Carvalho Ferreira
Comunidades ecológicas são organizadas, em termos simples, por espécies que co-ocorrem em um espaço e tempo, e suas abundâncias relativas, que sofrem flutuações de acordo com a dinâmica populacional de cada espécie, que é balanço de natalidade, mortalidade e migrações. Dentre os fenômenos que regulam a mortalidade está a interação interespecífica de predação, que possui efeito imediato de redução do número de indivíduos de uma população de presas. No entanto, a predação pode atuar na estruturação de comunidades para além da mortalidade direta (HOLT, 2009). Devido à complexidade das teias alimentares, a predação de uma espécie pode desencadear respostas em outras, as quais estão interligadas indiretamente (WERNER, 2003). Por exemplo, a preferência alimentar do predador pode causar o aumento da diversidade quando a presa preferida é a melhor competidora, reduzindo assim sua densidade e favorecendo a coexistência de espécies de nichos similares (LUBCHENCO, 1978). Entretanto, a predação pode causar modificações indiretas ainda mais profundas. Na presença de predadores, alguns indivíduos são capazes de alterar seu fenótipo, devido a plasticidade, a fim de evitar serem predados. Tais modificações podem ser de desenvolvimento, de história de vida, morfológicas, fisiológicas e comportamentais. A esses efeitos damos o nome de interações indiretas mediadas por atributo (trait-mediated indirect interactions), ou interações comportamentais indiretas (behavioral indirect interactions), ou modificações de interação (interaction modifications) (WERNER, 2003). Em outras palavras, a presença de um predador é capaz de alterar atributos na presa, que lhe permitem melhor evitação da predação, consequentemente modificando o efeito desta sobre a mortalidade da população, uma vez que predar torna-se mais difícil.
A maioria dos estudos de predador-presa foca no efeito letal do consumo da presa na densidade populacional, entretanto a influência do predador no fenótipo dos sobreviventes e em seus padrões comportamentais, efeitos não letais, podem ser tão significantes para a densidade quanto o consumo (WERNER, 2003). Experimentos realizados com ninfas de libélulas Tramea lacerata e Erythemis simplicicollis, e sua presa compartilhada, ninfas de donzelinha (Zygoptera), demonstraram que menos da metade das presas foram consumidas por E. simplicicollis, quando na presença de T. lacerata, que é predadora de E. simplicicollis, ainda que parte das ninfas de T. lacerata estivessem experimentalmente incapacitadas de predar (WISSINGER & MCGRADY, 1993). A redução populacional de E. simplicicollis devido a predação por T. lacerata explica apenas parcialmente a diminuição do consumo de presas pela primeira. A redução da mortalidade das presas deve-se também a mudanças comportamentais de Erytremis simplicicollis na presença do predador. Nesse caso, é provável que o efeito de interferência de uma espécie em outra seja resultado de uma demanda conflitante entre o forrageio e evitar a predação. Dessa forma, ao evitar ser predada por Tramea lacerata, Erytremis simplicicollis reduz sua taxa de forrageio e sua capacidade competitiva em relação a presa compartilhada (WISSINGER & MCGRADY, 1993).
Há casos em que as mudanças comportamentais são acompanhadas por alterações morfológicas. Anfíbios possuem uma grande diversidade de respostas induzidas por predadores devido a sua plasticidade fenotípica. Em estudo realizado com seis espécies de anuros e seus respectivos predadores, Relyea (2001) observou que, assim como para outros taxa, uma das respostas comportamentais exibidas é a diminuição da atividade na presença de predadores, além da evitação espacial. Todas as espécies de girinos apresentaram também alterações morfológicas em suas caudas quando na presença de pelo menos um de seus predadores. Enquanto comportamentos menos ousados garantem a segurança, apresentam demanda conflitante ao diminuírem a taxa de forrageio. Em contraponto as alterações na cauda possibilitam melhor desempenho no nado e fuga, contribuindo também para melhor forrageio e aproveitamento para o desenvolvimento, em detrimento de maior investimento energético (RELYEA, 2001).
Mudanças comportamentais e morfológicas predador-específicas parecem ser difundidas entre os taxa (animais e plantas), e distintas entre as espécies para um mesmo predador. A capacidade de distinguir entre predadores, e ajustar sua resposta à ameaça em potencial, é uma habilidade importante para que não haja investimento desnecessário em estratégias anti-predação, ou baixo investimento que cause risco de predação. Atributos comportamentais são mais plásticos que atributos morfológicos, logo mais fáceis de serem observados sob variações ambientais (RELYEA, 2001). Possíveis respostas comportamentais induzidas por predação são a redução ou aumento de atividade/movimentação, mudança de habitat, e busca por refúgios (WERNER, 2003).
A modulação comportamental pode ser observada a partir de diversos parâmetros e sempre está associada à tomada de decisão por um indivíduo frente a um estímulo. Durante minha graduação em Ciências Biológicas me dediquei a estudar experimentalmente as respostas comportamentais de formigas poneromorfas frente a coespecíficas não companheiras de ninho. Tendo como variável moduladora o gradiente de urbanização em três níveis (urbano, intermediário e natural), observamos como díades de formigas de ambientes de gradientes diferentes adaptam seu comportamento. Nossas previsões de que os comportamentos apresentados por formigas de ambientes diferentes seriam distintos foram corroboradas por nossos resultados (FERREIRA et al., dados não publicados). Durante as análises, hipóteses sobre padrões observados como atenuação do comportamento agonístico em ambiente urbano, me motivaram a seguir investigando possíveis impactos da urbanização no comportamento de formigas, como o aumento da atividade de forrageio, somado a diminuição da agressividade, reportado para colônias urbanas da formiga Temnothorax nylanderi (JACQUIER et al., 2023).
A atenuação do comportamento agonístico em grupos que apresentam aumento da atividade pode ser explicada pelo número maior de encontros intraespecíficos durante o forrageamento, que permite familiarização das colônias (SANADA-MORIMURA et. al, 2003). Entretanto, qual seria o fator motivador para o aumento de forrageio? Alguns vertebrados (aves e mamíferos) apresentam personalidades mais ousadas em ambientes urbanos, o que lhes permite melhor exploração de recursos. Nas cidades, populações sinantrópicas são expostas a diferentes fatores ambientais e estressores em relação a seus habitats naturais, e são submetidos a alterações alimentares (origem artificial), recursos espacialmente centrados e mudanças da comunidade de predadores (SOL et al., 2013). As leituras referentes aos efeitos não letais da predação me levaram a refletir se, em ambientes urbanos, a ausência de predadores naturais de formigas estaria possibilitando maior atividade de forrageamento, uma vez que o risco de predação seria menor. Tal possibilidade acrescenta fatores que não havia pensado em estudar a princípio. Meus objetivos iniciais buscavam responder se o aumento da atividade de forrageio é observado para meu modelo e, se esse aumento tem influência na prestação de serviços ecossistêmicos (dispersão de sementes), considerando variáveis ambientais, vegetação e recursos alimentares, sem, no entanto, considerar os efeitos causados pela ausência ou presença de uma comunidade de predadores.
Em conclusão, estudar os efeitos indiretos da predação é importante para compreender como as interações entre espécies atuam na estruturação da comunidade. Os efeitos diretos da predação explicam parcialmente o observado nas densidades populacionais, as alterações comportamentais também devem ser consideradas para entender as dinâmicas presentes na comunidade.
Referências Bibliográficas
FERREIRA, A. M. C. et al. Efeito da urbanização sobre interações intraespecíficas: Repertório comportamental da formiga Pachycondyla striata. Trabalho de Conclusão de Curso (Graduação em Ciências Biológicas) – Instituto de Biociências, Universidade de São Paulo, São Paulo, 2023.
HOLT, R.D. Predation and community organization. Cap. III.3, The Princeton Guide to Ecology.
JACQUIER, L.; MOLET, M.; DOUMS, C. Urban colonies are less aggressive but forage more than their forest counterparts in the ant Temnothorax nylanderi. Animal Behaviour, v. 199, p. 11-21, 2023.
LUBCHENCO, J. (1978). Plant species diversity in a marine intertidal community: importance of herbivore food preference and algal competitive abilities. American Naturalist, 23-39.
RELYEA, R.A., 2001. Morphological and behavioral plasticity of larval anurans in response to different predators. Ecology, 82(2), pp.523-540.
SANADA-MORIMURA, S. et al. Encounter-induced hostility to neighbors in the ant Pristomyrmex pungens. Behavioral Ecology, v. 14, n. 5, p. 713-718, 2003.
SOL, D.; LAPIEDRA, O. l; GONZÁLEZ-LAGOS, C.. Behavioural adjustments for a life in the city. Animal behaviour, v. 85, n. 5, p. 1101-1112, 2013.
WERNER, E.E. and PEACOR, S.D., 2003. A review of trait-mediated indirect interactions in ecological communities. Ecology, 84(5), pp.1083-1100.
WISSINGER, S., & MCGRADY, J. (1993). Intraguild Predation and Competition Between Larval Dragonflies: Direct and Indirect Effects on Shared Prey. Ecology, 74(1), 207–218. doi:10.2307/1939515