Tabela de conteúdos
Adeus bagunça! Quatro processos que organizam a ecologia de comunidades
Samanta Iop
O objetivo da ecologia de comunidade é entender quais são os mecanismos que geram padrões de riqueza e abundância das espécies na natureza. As perguntas centrais em ecologia de comunidades são: 1) por que algumas comunidades têm maior riqueza do que outras? 2) Por que comunidades apresentam composição de espécies diferentes? 3) Por que as espécies têm tamanhos populacionais diferentes? Apesar do objetivo e das perguntas serem claros, diferentes abordagens ao longo do histórico de pesquisas em ecologia de comunidades têm sido utilizadas para responder essas questões. Por exemplo, para a questão 1 podemos avaliar o efeito das interações entre as espécies através da competição, predação e mutualismo; para a questão 2 podemos verificar a influência da heterogeneidade espacial e temporal, as quais podem gerar composições de espécies diferentes entre as comunidades; para a questão 3 podemos avaliar a migração dos indivíduos entre comunidades e a competição intraespecífica e interespecífica. Aparentemente, temos um grande número de processos que geram os padrões de riqueza, abundância e composição nas comunidades. E para complicar ainda mais, a maneira com que esses processos interagem para determinar a dinâmica de comunidades varia de caso em caso. É por isso que a ecologia de comunidades é considerada uma bagunça, pois diferentes processos podem gerar os mesmos padrões nas comunidades (Vellend 2010).
A ‘bagunça’ é um tema recorrente nas discussões sobre ecologia de comunidades, e esta expressão foi associada à ecologia por Laweton no final da década de 90 (Laweton 1999). Porém, com a ajuda do artigo de Vellend (2010), podemos dar adeus a essa bagunça! Vellend (2010) argumenta que os processos podem ser divididos em quatro classes: seleção, deriva, especiação, e dispersão. Consequentemente, todos os modelos teóricos e conceituais em ecologia de comunidades podem ser entendidos/interpretados com relação à sua ênfase nestes quatro processos. A seleção representa diferenças de aptidão determinísticas entre as espécies, isto é, a presença das espécies nas comunidades são determinadas pela interação intraespecífica e interespecífica, e pela interação das espécies com o ambiente. A seleção tem sido frequentemente investigada sob a perspectiva de nicho (ver Chase e Leibold 2003). A deriva representa mudanças estocásticas na abundância das espécies nas comunidades, e é estudada pela visão da teoria neutra (ver Hubbell 2001). A teoria neutra prediz que todos os indivíduos são ecologicamente equivalentes e têm a mesma probabilidade de reproduzir, morrer, especiar e colonizar novos habitats. Assim, possíveis diferenças na abundância das espécies nas comunidades são geradas por flutuações demográficas estocásticas, sendo as características ambientais pouco importantes (Chesson 2000, Hubbell 2001). A dispersão é o movimento dos organismos ao longo do espaço, e sua influência sobre a comunidade está relacionada ao tamanho e a composição das comunidades. Atualmente esse processo é avaliado em pesquisas com metacomunidade (ver Holyoak et al. 2005). Por fim, a especiação gera novas espécies, sendo, portanto, o processo de origem de todas as espécies que ocorrem nas comunidades. Em uma escala local e temporal restrita, a especiação não apresenta muita relevância, e a dispersão pode ser interpretada como a origem das espécies na comunidade. No entanto, para escalas geográficas e temporais maiores, avaliar a especiação é extremamente importante, o que pode ser investigado com a utilização de filogenias (MacArthur 1969, Ricklefs 1987).
Organizar o conhecimento da ecologia de comunidades sob a perspectiva desses quatro processos gera ao menos três benefícios: 1) esclarece as semelhanças e diferenças essenciais entre as muitas abordagens conceituais e teóricas da disciplina, e pode auxiliar inclusive nos livros textos de ecologia de comunidades; 2) permite a articulação de uma teoria geral sobre a ecologia de comunidades, i.e. ‘espécies são adicionadas às comunidades através de especiação e dispersão, e a abundância relativa dessas espécies é então moldada por deriva e seleção, sob a influência da dispersão, os quais governam a dinâmica de comunidades’ (Vellend 2010); 3) encerra as discussões sobre qual modelo ou teoria é mais adequado para o sistema estudado. Em consequência, o cerne das discussões passa a ser sobre qual é o processo que governa a dinâmica da comunidade, ou quais são os processos que estão agindo juntos e qual é a importância de cada um em relação ao grupo e escala do estudo. O objetivo que emerge dessa visão unificadora é de que precisamos desvendar a “caixa preta” da ecologia de comunidades, isto é, acabar com a lacuna entre os processos e os padrões ecológicos e revelar o que faz com que diferentes processos gerem um mesmo padrão (ver figura 3 de Vellend 2010).
Diante do exposto, posso afirmar que o conhecimento em ecologia de comunidades está organizado, e que as futuras pesquisas devem buscar desvendar a ‘caixa preta’ da ecologia de comunidades. A pergunta que emerge agora é: como avançar o conhecimento em ecologia de comunidades e fazer pesquisas de excelência? Vellend (2010) aponta algumas linhas de pesquisa promissoras, a saber: equalização x mecanismos estabilizadores de coexistência (Chesson 2000), controles locais x regionais na estrutura da comunidade (Ricklefs e Schlutes 1993), e o próprio conceito de metacomunidade (Holyoak et al. 2005). É por esse caminho ainda pouco explorado que planejo seguir com minha carreira de pesquisas em ecologia de comunidades, investigando os tópicos que despertam meu interesse, como: i) descrição dos padrões de metacomunidade embasadas em teorias e conceitos ecológics, como as teorias neutra (Hubbell 2001), moderna da coexistência (Chesson 2000) e a partição da betadiversidade (Baselga 2010); ii) avaliação da influência dos processos na dinâmica de comunidades através de experimentos e modelos matemáticos; iii) descrição do padrão de organização de metacomunidades, levando em conta diferentes escalas espaciais; iv) descrição de padrões taxonômicos, funcionais e filogenéticos de metacomunidades. Vale a pena destacar que a avaliação da betadiversidade em metacomunidades tem o objetivo de verificar se a padrão da diversidade é aninhado ou se ocorre substituição de espécies entre as comunidades. E a descrição dos padrões filogenéticos da metacomunidade permite averiguar os processos históricos envolvidos na organização da metacomunidade.
Os tópicos de pesquisa acima citados podem ser investigados com diferentes grupos animais e vegetais. No entanto, eu utilizo anfíbios anuros para testar as teorias e conceitos ecológicas, dado que são bons modelos de estudo porque: a) habitam corpos d’água lênticos (e.g., poças) que têm seus limites facilmente reconhecíveis e podem ser comparados a ilhas isoladas; b) apresentam uma organização complexa das comunidades devido ao modo de vida bifásico da maioria das espécies (adultos habitam ambientes terrestres e os girinos se desenvolvem em habitats aquáticos), c) além de terem capacidade de dispersão limitada. Essas características os tornam extremamente dependentes dos corpos d’água e da matriz que circunda os ambientes reprodutivos. Diante dos argumentos apresentados, é possível utilizar os anuros como modelo para testar teorias e conceitos ecológicos através pesquisas sob a abordagem de Vellend (2010). Por exemplo, a maioria das pesquisas com anuros têm focado na descrição dos padrões das comunidades gerados por seleção, principalmente sobre a perspectiva clássica de nicho. Porém, a deriva (processo neutro) também pode influenciar os padrões da comunidade de anuros. Nesse sentido, Adler et al. (2007) argumenta que as teorias neutras e de nicho focam em processos complementares e que pode ser possível delimitar casos em que a equivalência ecológica, tipicamente neutra, se aplica dentro da perspectiva de nicho. Assim, processos relacionados ao nicho e processos neutros podem ser melhor interpretados com o auxílio da teoria moderna da coexistência, onde os padrões podem ser descritos por mecanismos estabilizadores (relacionados a sobreposição do nicho das espécies) e equalizadores (relacionados a competitividade das espécies). Por outro lado, a avaliação dos processos pode ser avaliada com experimentos em microcosmos; uma pesquisa em potencial poderia incluir a avaliação de como diferentes taxas de dispersão artificial de girinos pode organizar as comunidades de anuros. Para isso, seria necessário coletar girinos de espécies que co-ocorrem e mantê-las em tanques artificiais. Alternativamente, poderia ser testada a influência de processos sobre as comunidades de anuros através de modelagem matemática.
Em resumo, a visão unificadora proposta por Vellend (2010) – na qual somente quatro processos (seleção, deriva, especiação, e dispersão) agem juntamente para gerar os padrões de riqueza, abundância e composição de espécies na comunidade – torna mais fácil o entendimento da ecologia de comunidades. Dessa forma, torna-se possível identificar as lacunas de conhecimento da área, o que permite desenvolver trabalhos de excelência que tenham por objetivo preencher a lacuna entre processos e padrões e, assim, avançar significativamente o conhecimento na ecologia de comunidades.
Referências bibliográficas
Adler P. B., Hillerislambers I., Levine J. M. 2007. A niche for neutrality. Ecology Letters, 10:95–104.
Baselga A. 2010. Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19:134–143.
Chase J. M., Leibold M. A. 2003. Ecological niches: linking classical and contemporary approaches. Chicago (IL): University of Chicago Press.
Chesson P. 2000. Mechanisms of maintenance of species diversity. Annual Review of Ecology and Systematics, 31:343–366.
Holyoak M., Leibold M. A., Holt R. D. 2005. Metacommunities: spatial dynamics and ecological communities. Chicago (IL): University of Chicago Press.
Hubbell S. P. 2001. The unified neutral theory of biogeography and biodiversity. Princeton (NJ): Princeton University Press.
Lawton J. H. 1999. Are there general laws in ecology? Oikos, 84:177–192.
MacArthur R. H. 1969. Patterns of communities in the tropics. Biological Journal of the Linnean Society, 1(1–2):19–30.
Ricklefs R. E. 1987. Community diversity: relative roles of local and regional processes. Science, 235(4785):167–171.
Ricklefs R. E., Schluter D. 1993. Species diversity in ecological communities: historical and geographical perspectives. Chicago (IL): University of Chicago Press.
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quaterly Review of Biology, 85:183–206.
O potencial do conceito de metacomunidades para entendermos as dinâmicas de comunidades em paisagens alteradas
Rodolfo Mei Pelinson
Por muito tempo a ecologia de comunidades considerou explicitamente apenas processos locais baseados em ideias de nicho (HUTCHINSON, 1957, 1959) na estruturação de comunidades, ou seja, as espécies ocorrem apenas em habitats que apresentam as condições ideais para que elas ocorram. Essa ideia se baseia em grande parte em interações entre as espécies, como competição e predação (e.g. CONNELL, 1980). Já a influência de processos de dispersão sobre as dinâmicas e estrutura das comunidades foi considerada explicitamente pela primeira vez após os anos 60 com a Teoria de Biogeografia de Ilhas (MACARTHUR; WILSON, 1967) e mais tarde com a Teoria Neutra (HUBBELL, 2001). No entanto, as duas teorias assumem que as espécies não possuem diferenças de nicho, fitness (i.e. capacidade máxima da espécie de converter recursos em prole, em condições ideais de nicho) ou capacidade de dispersão, importando apenas limitações físicas, como barreiras, distância geográfica e tamanho do habitat (HUBBELL, 2001; MACARTHUR; WILSON, 1967). Além disso, segundo essas teorias, as comunidades recebem espécies indefinidamente de um pool regional de espécies (HUBBELL, 2001) ou de um continente (MACARTHUR; WILSON, 1967). Nesse contexto, o surgimento do conceito de metacomunidades foi importante por incorporar nas dinâmicas das comunidades tanto processos de dispersão quanto de nicho, e por considerar a imigração de espécies de outras comunidades locais e não necessariamente de um continente ou um pool geral de espécies. Dessa forma, segundo esse conceito, uma metacomunidade é um conjunto de comunidades locais potencialmente conectadas por dispersão de indivíduos de espécies que interagem entre si (HOLYOAK; LEIBOLD; HOLT, 2005; LEIBOLD; MIKKELSON, 2002; LEIBOLD et al., 2004).
Apesar do aparente potencial do conceito de metacomunidades para se entender a estruturação de comunidades, ele tem sido amplamente criticado por ser usualmente abordado na forma de quatro diferentes perspectivas não mutualmente excludentes (HEINO et al., 2015; VELLEND, 2010; WINEGARDNER et al., 2012). Essas perspectivas são: a de dinâmica de manchas, a de efeito de massa, a de filtragem de espécies, e a dinâmica neutra (LEIBOLD et al., 2004). Na perspectiva de dinâmica de manchas, as manchas (i.e. comunidades locais) possuem igual qualidade para as espécies enquanto que estas variam apenas na capacidade de colonização e dispersão (LEIBOLD et al., 2004). Já na filtragem de espécies, as manchas de habitat variam em qualidade, e a dispersão das espécies é suficiente para que elas ocorram nas manchas que são mais adequadas à elas (LEIBOLD et al., 2004). Na perspectiva de efeito de massa as manchas de habitat variam em qualidade, mas as taxas de dispersão são tão altas que todas as espécies conseguem estar presentes em todas as manchas por meio de dinâmicas fonte-dreno (LEIBOLD et al., 2004). Por fim, a perspectiva de dinâmica neutra assume que as espécies são equivalentes em seus requerimentos ambientais e as extinções locais ocorrem de forma aleatória. As principais críticas a essa visão do conceito de metacomunidades focam principalmente na sobreposição conceitual de cada uma dessas perspectivas e no fato de que os mesmos processos podem estar atuando em cada uma delas (HEINO et al., 2015; VELLEND, 2010; WINEGARDNER et al., 2012). Por exemplo, as perspectivas de efeito de massa e filtragem de espécies são influenciadas igualmente por diferenças de nicho das espécies, sendo que o que as difere é a intensidade das taxas de dispersão (HEINO et al., 2015; VELLEND, 2010; WINEGARDNER et al., 2012). Já no caso das perspectivas de dinâmica de manchas e dinâmica neutra a qualidade dos habitats não importa, importando apenas se as espécies possuem diferenças nas capacidades de dispersão e colonização ou não (VELLEND, 2010). Assim, casos intermediários entre essas perspectivas acabam ficando sem uma definição clara dos processos que estão atuando. Por isso, eu proponho enxergar o conceito de metacomunidades à luz dos principais processos estruturadores de comunidades propostos por VELLEND (2010): seleção, deriva, dispersão e especiação.
Como observado por VELLEND (2010), o conceito original de metacomunidades já incluí processos de dispersão, seleção (i.e. nicho) e deriva. A influência maior ou menor das condições abióticas ou das interações bióticas (e.g. competição, predação e facilitação) na diversidade e composição de espécies de uma comunidade podem ser vistas como um balanço entre processos de seleção e deriva. Nesse caso, processos de seleção atuariam mais fortemente em manchas com maiores diferenças nas condições abióticas e onde as diferenças de nicho e interações (i.e. competição, predação e facilitação) são mais intensas. Já a deriva atuaria mais fortemente em manchas pequenas que suportam tamanhos populacionais pequenos, ou em comunidades onde as espécies não possuem muitas diferenças de nicho e as interações são menos importantes. Nesses casos processos estocásticos determinariam a composição de espécies (VELLEND, 2010). O balanço entre as limitações físicas à dispersão (i.e. distância entre os habitats e barreiras geográficas) e a capacidade de dispersão das espécies (i.e. capacidade de transpor as barreiras) poderiam ser classificados como processos de dispersão, mantendo as comunidades locais mais ou menos isoladas. A quarta classe de processos é chamada de processos de especiação (VELLEND, 2010) e leva em consideração a história evolutiva das espécies. Essa última classe não é explicitamente considerada nas perspectivas de metacomunidades inicialmente propostas (LEIBOLD et al., 2004; VELLEND, 2010), no entanto, esses processos podem ser facilmente incluídos, uma vez que precisamos apenas definir a história evolutiva das espécies com as quais estamos trabalhando e considerar a escala espacial e temporal do trabalho. Por exemplo, considerando apenas a escala espacial, se estamos trabalhando em uma extensão geográfica grande o suficiente para envolver duas áreas biogeográficas diferentes (e.g. Mata Atlântica e Cerrado), precisamos considerar o contexto onde as espécies evoluíram e como os processos de dispersão, deriva e seleção variam em importância e efeito nessas diferentes áreas. Se estamos trabalhando em uma escala temporal grande, precisamos considerar possíveis eventos de especiação nas metacomunidades. Por exemplo, em metacomunidades onde nós temos maiores taxas de dispersão dentro de determinados grupos de comunidades, e menores taxas de dispersão entre esses grupos, eventuais eventos de especiação podem ocorrer dentro de cada grupo (i.e. especiação simpátrica).
Essa visão de metacomunidades pode ser especialmente útil para entendermos como alterações antrópicas podem alterar a composição e diversidades de espécies nas comunidades e metacomunidades. Os processos de especiação (i.e. históricos e biogeográficos) são importantes nesse contexto, principalmente na definição das características das espécies (i.e. diferenças ou semelhanças de nicho, fitness e capacidade de dispersão). Por exemplo, em determinadas áreas, as espécies podem ter evoluído em um contexto onde as pressões seletivas fizeram com que tivessem requerimentos ambientais diferentes (i.e. diferenciação de nicho). Já em uma outra área, as pressões podem ter favorecido espécies sem requerimentos específicos. Em casos como esses, os efeitos de alterações ambientais na diversidade e composição de espécies em cada uma dessas áreas deve variar bastante. Aqui eu classifico as alterações ambientais como sendo de três tipos: Alterações nas condições dos habitats locais independentemente do tamanho; alterações no tamanho dos habitats locais; e alterações na permeabilidade da matriz entre os habitats locais (i.e. tornar a matriz mais ou menos inóspita). A alteração nas condições dos habitats pode ser vista por diferentes aspectos como alterações nas condições abióticas (e.g. temperatura e umidade), ou mesmo nas condições bióticas (superexploração de um determinado grupo de espécies). Dessa forma, em comunidades onde as espécies possuem diferenças de nicho e de fitness, processos de seleção são importantes na manutenção de uma determinada composição e diversidade de espécies em determinadas condições do habitat (VELLEND, 2010). Alteradas essas condições, esses mesmos processos serão responsáveis por determinar uma composição e diversidade de espécies diferente (Figura 1A). Somado a isso, a redução de tamanho dos habitats locais pode, além de reduzir a qualidade do habitat, reduzir os tamanhos populacionais das espécies (CONNOR; COURTNEY; YODER, 2000; MATTHEWS et al., 2014) fazendo com que fiquem mais sujeitas a processos de deriva (VELLEND, 2010; Figura 1A). Caso as espécies nas comunidades locais não possuam requerimentos ambientais específicos, a tendência é que processos de deriva ocorram muito mais fortemente do que processos de seleção. Nesse caso, a mudanças nas condições ambientais dos habitats terão pouco efeito sobre a diversidade e composição de espécies (Figura 1B). Além disso, novamente, se diminuirmos o tamanho desses habitats, o mais provável é que os processos de deriva se intensifiquem (Figura 1B).
As alterações antrópicas não ocorrem apenas nos habitats locais. Elas podem ocorrer também na matriz de habitat (i.e. espaço entre as manchas de habitats locais por onde os indivíduos se dispersão até outras manchas) tornando-a mais ou menos permeável à dispersão (JULES; SHAHANI, 2003). Supondo que as espécies em uma metacomunidade possuem capacidade de dispersão semelhante (Figura 1C), se uma matriz for muito impermeável, as comunidades vão estar praticamente isoladas umas das outras, aumentando a importância de processos ocorrendo em escala local (i.e. escala da comunidade) já discutidos no parágrafo anterior, principalmente processos de deriva (Figura 1C). No entanto, matrizes mais permeáveis podem promover maior troca de indivíduos entre as manchas (JULES; SHAHANI, 2003; Figura 1C), o que pode alterar o resultado dos processos que ocorrem em cada mancha. Outras possibilidades existem se, no lugar de supormos que as espécies possuem capacidade de dispersão semelhante, imaginarmos que elas diferem nesse aspecto (Figura 1D). Nesse caso diferentes tipos de alterações podem beneficiar ou prejudicar a dispersão um determinado grupo de espécies em detrimento de outro (JULES; SHAHANI, 2003).
Esses diferentes efeitos gerados por esses quatro processos podem interagir de diversas maneiras, gerando dinâmicas totalmente diferentes e não necessariamente previstas pelas quatro perspectivas de metacomunidades inicialmente propostas por LEIBOLD et al. (2004). Aqui essas quatro perspectivas se apresentariam como algumas das combinações possíveis desses processos. Por exemplo, teríamos uma dinâmica de efeito de massa se as espécies possuírem diferenças de nicho e fitness, se as manchas diferirem em qualidade, e se a matriz de habitats for muito permeável à dispersão de todas as espécies. Já outras situações não são previstas por essas quatro perspectivas. Por exemplo, se as manchas não diferem nas condições ambientais, as espécies possuem diferenças de fitness, e a matriz do habitat é muito permeável à dispersão, a tendência é que mesmo que em algumas manchas eventos estocásticos favoreçam as espécies de menor fitness, a chegada constante de migrantes favorecerá as espécies de maior fitness, levando à dominância dessa espécie em toda a metacomunidade por processos de seleção. Por tanto, eu acredito que com essa visão mais mecanicista de metacomunidades é possível que possamos prever de forma muito mais clara e eficiente os principais processos que podem afetar a diversidade e composição de espécies nas comunidades e metacomunidades sujeitas a diferentes pressões antrópicas. Esse maior entendimento das dinâmicas de metacomunidades nessas paisagens poderia auxiliar em um manejo mais eficiente de áreas alteradas e no melhor planejamento de futuras alterações.
Referências bibliográficas
CONNELL, J. H. Diversity and the Coevolution of Competitors, or the Ghost of Competition Past. Oikos, v. 35, n. 2, p. 131–138, 1980.
CONNOR, E. F.; COURTNEY, A. C.; YODER, J. M. Individuals-Area Relationships: The Relationship between Animal Population Density and Area. Ecology, v. 81, n. 3, p. 734–748, mar. 2000.
HEINO, J. et al. Metacommunity organisation, spatial extent and dispersal in aquatic systems: patterns, processes and prospects. Freshwater Biology, v. 60, n. 5, p. 845–869, 2015.
HOLYOAK, M.; LEIBOLD, M. A.; HOLT, R. D. Metacommunities: spatial dynamics and ecological communities. [s.l.] University of Chigago Press, 2005.
HUBBELL, S. P. The unified neutral theory of biodiversity and biogeography. [s.l.] Princeton University Press, 2001.
HUTCHINSON, G. E. Concluding Remarks. Cold Spring Harbor Symposia on Quantitative Biology, 1957.
HUTCHINSON, G. E. Homage to Santa Rosalia or Why Are There So Many Kinds of Animals? The American Society of Naturalists, v. 93, n. 870, p. 145–159, 1959.
JULES, E. S.; SHAHANI, P. A broader ecological context to habitat fragmentation: Why matrix habitat is more important than we thought. Journal of Vegetation Science, v. 14, n. 3, p. 459–464, 2003.
LEIBOLD, M. A. et al. The metacommunity concept: A framework for multi-scale community ecology. Ecology Letters, v. 7, n. 7, p. 601–613, 2004.
LEIBOLD, M. A.; MIKKELSON, G. M. Coherence , species turnover , and boundary clumping : elements of meta-community structure. Oikos, v. 97, n. October 2001, p. 237–250, 2002.
MACARTHUR, R. H.; WILSON, E. O. The Theory of Island Biogeography. [s.l.] Princeton University Press, 1967.
MATTHEWS, T. J. et al. Thresholds and the species-area relationship: A synthetic analysis of habitat island datasets. Journal of Biogeography, v. 41, n. 5, p. 1018–1028, 2014.
VELLEND, M. Conceptual synthesis in community ecology. The Quarterly review of biology, v. 85, n. 2, p. 183–206, 2010.
WINEGARDNER, A. K. et al. The terminology of metacommunity ecology. Trends in Ecology and Evolution, v. 27, n. 5, p. 253–254, 2012.
Paleocomunidades e teoria geral da ecologia de comunidades
Gustavo A. Ballen
A ecologia de comunidades é um campo de pesquisa ainda em constante estruturação teórica, mas que resulta extremamente importante dado seu impacto sobre outros campos de pesquisa biológica. É por natureza um campo de síntese, onde diversos procesos/teorías tem sido identificadas como importantes na hora de estruturar as comunidades biológicas, e assim, tais processos normalmente são tratados como prioritarios na hora de definir uma teoría de ecología de comunidades, bem individualmente, ou em combinação. Esta ultima abordagem integradora visa acabar com a ambiguidade sobre se existe de fato uma teoria unificada de ecología de comunidades, o que tem profundas implicações para a pesquisa ecológica e a maneira como tal conhecimento é construido (Vellend, 2010).
Ainda sendo um campo de muita relevancia para outras areas das ciências biológicas, e até fora daquelas, infelizmente não existe um consenso sobre o basamento teórico da área, se tem merito o desenvolver um unificado, ou se tal campo não seria mais do que uma coleção de explicações contingentes, na qual o objetivo da ecologia de comunidades seria explicar caso a caso cada comunidad sem conseguir chegar a generalidades sobre a natureza das mesmas (Hoffmann, 1979; Roughgarden, 2009; Vellend, 2010). O estado de “anarquia” atual da ecología de comunidades, o que o Vellend chamou de “bagunça”, é basicamente o que o levou a postular que é possível porpor uma teoría geral de ecologia de comunidades ao perceber que quatro procesos são importantes na hora de criar e manter uma comunidade. O interesse dele era criar um paradigma analogo com aquele da genética de populações, onde quatro processos analogos acontecem e são necessários e suficientes para qualificar como teoría.
As comunidades apresentam um contexto temporal que é implicitamente considerado ao estudar dinâmicas em si, mas que geralmente não ocupa um papel visível na teoría de ecología de comunidades, talvez abaixo a suposição de que os processos ecológicos ocorrem numa escala temporal curta que é capturada no estudio de comunidades viventes. Agora no caso das comunidades no tempo geológico aquilo toma maior importância, pois nesta escala temporal é possível perceber processos que não poderiam ser estudados em curtas escalas temporais. Isso faz com que o estudo das comunidades extintas (as paleocomunidades) seja de extrema importância na hora de estudar processos importantes na estruturação e dinâmica das comunidades, e assim, proporcionam um modelo de estudo onde os cambios ao longo do tempo podem ser estudados numa maneira mais clara do que é possível com comunidades viventes ou experimentais.
Infelizmente, se atualmente ainda falta uma unificação na teoría de comunidades, aquilo não parece ser diferente no estudo de paleocomunidades, onde além das mesmas diferências conceptuais encontradas no estudo das comunidades recentes, existe uma diversidade de visões sobre o que uma paleocomunidade é. Por exemplo, uma paleocomunidade é as vezes vista como simplesmente as espécies que são encontradas num mesmo nível (ou níveis) de rocha, o que iguala paleocomunidad com composição, e não vai além de um listado taxonomico (Kay et al., 1997). Adicionalmente, aspectos como sua composição e as densidades relativas são considerados como importantes de uma comunidade (Staff et al., 1986; Bush & Bambach, 2004). O conceito de nicho é as vezes implícitamente incorporado ao estudar competição e o seu papel na estruturação de comunidades (Scott, 1978; Ausich, 1983), e até abordagens de metacomunidades tem sido incorporadas em estudos de paleocomunidades (Carrano et al, 2016). Uma particularidade das paleocomunidades é que geralmente só uma proporção da riqueza original é preservada devido a viés tafonômica, e potencial de preservação. Assim, além de incompleta, geralmente aquela amostra também pode não apresentar uma amostra proporcional das abundâncias originals. Finalmente, dependendo da janela temporal que camputa o corpo de rocha, aquilo que é percibido como uma comunidade pode ser uma comunidade promedio ao longo do intervalo temporal. Em síntese, o que percebemos das paleocomunidades depende das natureza dos fatores ambientais que favoreceram a depositação e fossilização
Agora, é possível pensar nas paleocomunidades abaixo uma abordagem integradora sensu Vellend (2010)? O autor cita cuatro processos chave na estruturação e manutenção das comunidades: Seleção, deriva, especiação e disperção. Desses processos todos tem sido estudados em organismos fósseis, mas não sem dificuldade. Talvez dele o mais dificil de estudar em paleocomunidades seja aquele de seleção, pois rara vez existe uma maneira de quantificar o fitness e as diferências neste parâmetro entre especies de uma paleocomunidade (mas por exemplo veja Briggs & Crother, 2003). Deriva pode ser estudada e quantificada usando series de densidade ao longo da coluna estratigráfica, o que proporciona uma visão da variação no numero de individuos ao longo do tempo; com bom controle estratigráfico este processo resulta fácil de estudar. Especiação tem sido um dos aspectos mais estudados em paleontologia e com certeza é o mais próximo a qualquer paleontólogo, mesmo sem interesse em paleoecología. Finalmente dispersão pode ser quantificada usando as abordagens de intervalos de confiância para intervalos estratigráficos (e.g., Strauss & Sadler, 1989; Marshall, 1994) para definir a aparição local de uma especie dado que seu intervalo seja maior.
Com base naquela abordagem, a paleoecologia tem a ganhar na hora de passar de uma ciência baseada em padrões (e.g., distribuição de abundâncias relativas, gradientes de diversidad) para uma baseada em processos, e assim, se movimentar de uma teoria fenomenológica para uma mecanicista, onde os processos são estudados diretamente numa abordagem que desambigua o fato de que um mesmo padrão pode ser gerado por differentes processos (Werner, 1998). Embora seja muito importante, o programa de pesquisa em paleoecologia parece ter focado até o momento em padrões e bem pouco ou quase nada em processos, se afastando da visão do Vellend (2010) de uma teorial geral de ecologia de comunidades. Como já foi dito, a paleoecologia tem muito a ganhar mas a transição para aquele paradigma ainda não acontece. A paleoecologia pode proporcionar modelos de estudo de comunidades ao longo do tempo geológico, o que tem o potencial de permitir distinguir padrões gerados por processos diferentes. Por exemplo, variações no pool regional de especies como sendo produto de especiação ou dispersão podem se distinguir perfeitamente numa abordagem ecológica onde a primeira corresponderá com maiores taxas de diversificação, enquanto que a segunda corresponderá com aparições locais em sequencias estratigraficas definidas, e expansões regionais da distribução das especies (Strauss & Sadler, 1989).
Finalmente cabe resaltar que uma transição para uma teoría geral das comunidades precisa da interação também com a paleoecologia toda vez que é possível considerar a dimensão espacial como medio para distinguir processos, e assim as paleocomunidades podem servir como modelo de estudo de processos particulares na escala temporal. Assim, aquela unificação não precisa somente do que poderia ser chamado de “neocomunidades” ou “neoecólogos”, mas também dos paleoecólogos, o que em soma poderia realmente gerar uma teoria unificada, resolvendo a incerteza da “caixa preta” das comunidades (Vellend 2010, fig. 3). Aquilo básicamente significa que a interação entre neoecólgos e paleoecólogos incorporando a teoría geral do Vellend tem o potencial de distinguir entre padroes e processos em ecologia de comunidades, um aspecto que mesmo com uma teoría geral de comunidades precisa ser resolvido.
Referências bibliográficas
Ausich, W. I. 1983. Component concept for the study of paleocommunities with an example from the early Carboniferous of northern Indiana (U.S.A.). Palaeogeography, Palaeoclimatology, and Palaeoecology. 44:251-282
Bush. A. M. & Bambach, R. K. 2004. Did alpha diversity increase during the Phanerozoic? Lifting the veils of taphonomic, latitudinal, and environmental biases. The Journal of Geology. 112:625-642
Carrano, M. T., Oreska, M. P. J. & Lockwood, R. 2016. Vertebrate paleontology of the Cloverly Formation (Lower Cretaceous), II: Paleoecology. Journal of Vertebrate Paleontology. In press.
Hoffmann, A. 1979. Community ecology as an epiphenomenal science. Paleobiology. 5(4):357-379
Kay, R. F., Madden, R. L., Cliffeli, R. L. & Flynn, J. J. 1997. Vertebrate Paleontology in the Neotropics: The Miocene Fauna of La Venta, Colombia. Smithsonian Institution Press, Washington, 608 pp.
Roughgarden, J. 2009. Is there a general theory of community ecology? Biology and Philosophy. 24:357-379
Scott, R. W. 1978. Approaches to trophic analysis of paleocommunities. Lethaia. 11:1-14
Staff, G. M., Stanton, R. G., Powell, E. N. & Cummins, H. 1986. Time averaging, taphonomy, and their impoact on paleocommunity reconstruction: Death assamblages in Texas bays. Geological Society of Aamerica Bulletin. 97:428-443
Strauss, D. & Sadler, P. M. 1989. Classical confidence intervals and Bayesian probability estimates for ends of local taxon ranges. Mathematical Geology. 21(4):411-427
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quarterly Review of Biology. 85(2):183-206
Aplicação da proposta de Vellend (2010) em ecologia de comunidades cavernícolas
Igor Cizauskas
Reconhecer quais são os processos envolvidos para compreender os mecanismos que estruturam uma comunidade, são premissas teóricas importantes no delineamento de estudos em ecologia de comunidades. Segundo Vellend (2010) embora muitas hipóteses de mecanismos tenham sido elaboradas para sustentar padrões em comunidades ecológicas, todos esses mecanismos envolvem apenas quatro tipos distintos de processos: seleção (uma diferença determinística de fitness entre indivíduos de espécies diferentes), deriva (mudanças aleatórias na abundância relativa das espécies), especiação (a criação de novas espécies) e dispersão (o movimento de organismos através do espaço). Dessa forma, a compreensão dos padrões de diversidade, abundância e composição de espécies em comunidades poderiam ser norteados pela avaliação destes quatro processos subjacentes aos padrões de cada comunidade.
Entretanto, reconhecer um processo de especiação, avaliar o poder de dispersão e/ou quantificar a abundância de qualquer espécie, independente do seu fitness, não está ligado às premissas teóricas e sim, ao estudo de história natural de cada espécie presente na comunidade. Embora tenham perdido seu brilho para a academia (Dayton 2003; Hansson 2003), os estudos tradicionais de história natural levantaram questões chaves para a interpretação dos processos e compreensão de mecanismos que estruturam as comunidades. Exemplos de trabalhos de naturalistas como Hutchinson (1957-59), Connell (1961), Lubchenco (1978), revelaram com base em observações in natura questões fundamentais sobre diferentes mecanismos que estruturam comunidades biológicas.
A avaliação dos diferentes processos e história natural das comunidades pode ser feita em qualquer escala. Um porem é que, quanto maior a diversidade de espécies da comunidade, maior o número de informações necessárias para entender os mecanismos que as estruturam. De acordo com Barr Jr., (1967) as comunidades de animais em cavernas parece, à primeira vista, oferecer oportunidades interessantes para a investigação da dinâmica de comunidades por causa de sua relativa simplicidade. Características como o baixo número de espécies na comunidade e o total de biomassa quando comparado com o ambiente externo, a ausência quase total de produtores primários (exceto autotrófos quimiossintetizantes) e características abióticas e estruturais singulares (ex. áreas áfoticas; ambientes oligotróficos) sugerem que o ambiente cavernícola (ambiente hipógeo) seja menos complexo de ser avaliado do que o ambiente externo (ambiente epígeo).
Por outro lado, a diversidade de espécies que habitam o ambiente cavernícola e as interações que estruturam a dinâmica dessas comunidades são extremamente complexas de serem avaliadas. Tanto a composição de espécies como a disponibilidade de recursos que mantém as populações em equilíbrio estão relacionadas com as flutuações ambientais constantes do ambiente epígeo. Culver & Pipan (2014), como outros autores antes deles, salientam que as cavernas seriam somente uma parte das informações, de forma que, para avaliar a dinâmica de uma comunidade cavernícola devem ser observadas e analisadas não somente informações restritas às cavidades mas também características das comunidades do ambiente epígeo como de outros ambientes subterrâneos (ex. meio superficial subterrâneo; epicarste, ambientes hipotelminorreicos).
Uma das interpretações da classificação de espécies cavernícolas, utilizada pela primeira vez por Schiner (1854) e modificada e popularizada por Racovitza (1907), divide as espécies localizadas no ambiente cavernícolas em quatro grupos ecológicos: (1) troglóbios, espécies cavernícolas obrigatórias; (2) troglófilos, espécies facultativas capazes de completar seu ciclo de vida tanto no ambiente cavernícola como no ambiente epígeo; (3) trogloxenos, espécies regularmente encontradas em cavernas, mas que necessitam retornar periodicamente à superfície para completar seu ciclo de vida; e (4) acidentais. Unido história natural com os conceitos de ecologia de comunidades, podemos pesquisar as entrelinhas dos processos de seleção, deriva, especiação e dispersão em cada um dos quatro grupos ecológicos e avaliar possíveis mecanismos que estruturam uma comunidade cavernícola. De forma resumida, os diferentes graus de isolamento das espécies no ambiente cavernícola podem ser representados por padrões ecológicos distintos. A figura 1 mostra a relação entre os grupos ecológicos e os processos de forma neutra (A), as características ambientais que estruturam a comunidade (B) e a avaliação de ambas as informações (C) interpretadas pela dinâmica da comunidade cavernícola.
 Figura 1. A – Exemplificação das possíveis relações entre os diferentes processos (seleção, deriva, especiação e dispersão) de forma neutra; B – Modelo simplificado da estrutura ambiental de uma caverna; C – Dinâmica da comunidade cavernícola.
Figura 1. A – Exemplificação das possíveis relações entre os diferentes processos (seleção, deriva, especiação e dispersão) de forma neutra; B – Modelo simplificado da estrutura ambiental de uma caverna; C – Dinâmica da comunidade cavernícola.
A pesquisa ecológica da comunidade é extremamente importante para a compreensão de várias questões de grande preocupação, incluindo o impacto e possível mitigação das mudanças ambientais globais (Simberloff, 2004). Os ecossistemas subterrâneos, onde as cavernas estão inseridas, apresentam problemas especiais para a conservação devido à sua intrínseca fragilidade e características específicas das comunidades, incluindo um alto grau de endemismo e diferenciação morfológica, ecológica e comportamental de espécies restritas ao ambiente hipógeo (troglóbios) (Culver, 1986). Entender a caixa preta que estrutura as comunidades cavernícolas é peça fundamental para elaboração de propostas sustentáveis e tomadas de decisão para a conservação desses ambientes naturais.
Referências bibliográficas
Connell, J.H., 1961. The influence of interspecific competition and other factors on the distribution of the barnacle Chthamalus stellatus. Ecology 42(4): 710-723;
Culver, D.C., 1986. Cave fauna. In M. E. Soule ́ (Ed.). Conservation biology: the science of scarcity and diversity, pp. 427– 443. Sinauer Associates, Sunderland, Massachusetts.
Culver, D.C. & Pipan, T., 2014. Shalow subterranean habitats: Ecology, Evolution and Conservation. Oxford University press. pp. 18 - 47
Dayton, P. K., 1972. Toward an understanding of community resilience and the potential effects of enrichments to the benthos at McMurdo Sound, Antarctica. Pages 81–95 in B. C. Parker, ed. Proceedings of the Colloquium on Conservation Problems in Antarctica. Allen, Lawrence, Kans;
Hansson, L., 2003. Why ecology fails at application: should we consider variability more than regularity? Oikos 100: 624–627;
Hutchinson, G.E., 1957. Concluding remarks. Cold Spring Harbor Symposia on Quantitative Biology 22: 415–427;
Hutchinson, G.E., 1959. Homage to Santa Rosalia or Why Are There So Many Kinds of Animals? The American Naturalist 93:145-159;
Lubchenco, J., 1978. Plant species diversity in a marine intertidal community: importance of herbivore food preference and algal competitive abilities. American Naturalist, 23-39;
Schiner, J. R., 1854. Fauna der Adelsberger-, Lueger- und Magdalen-Grotte. Verh. zool.-bot. Ges. Wien (Austria) 3:1-40.
Simberloff, D., 2004. Community ecology: is it time to move on? The American Naturalist, 163: 787–799;
Racovitza, Emil G., 1907. Essai sur les problèmes biospéologiques. Arch. zool. exp. et gen. 36:371- 488.
Thomas C. Barr, Jr., 1967. Observations on the Ecology of Caves. The American Naturalist, Vol. 101, No. 922 (Nov. - Dec., 1967), pp. 475-491;
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quaterly Review of Biology 85: 183-206.
Relação entre distúrbio e a teoria síntese de ecologia de comunidades: implicações do fogo na dinâmica de ecossistemas pirofíticos
Livia Carvalho Moura
A teoria de ecologia de comunidades sintetizada por Vellend (2010) é uma tentativa de simplificar o entendimento e o estudo desta área do conhecimento, em que os padrões encontrados em comunidades de diferentes ecossistemas estão associados a quatro processos: seleção, deriva, especiação e dispersão (Figura 1). Exemplos de alguns destes padrões encontrados na natureza são: relação entre a diversidade de espécies e espaço, tempo, latitude, elevação, produtividade e distúrbio; distribuição da abundância relativa das espécies, e; relação da composição de espécies local e regional (Morin, 1999; Ricklefs and Miller, 1999; Vellend, 2010). No entanto, os padrões geralmente são resultado da combinação entre diferentes processos, ou seja, os processos não atuam isoladamente (Vellend, 2010). Enquanto os processos de dispersão e especiação estão mais associados com a entrada de novas espécies nas comunidades, os processos de seleção e deriva estão mais relacionados a abundância relativa das espécies, sendo que apenas colonizam aquelas que conseguem se estabelecer e se adaptar ao ambiente e suas condições (Vellend, 2010). Geralmente quando o processo de seleção não atua diretamente na dinâmica de uma comunidade, a interação entre os processos de dispersão, deriva e especiação pode aumentar a riqueza de espécies (Vellend, 2010).
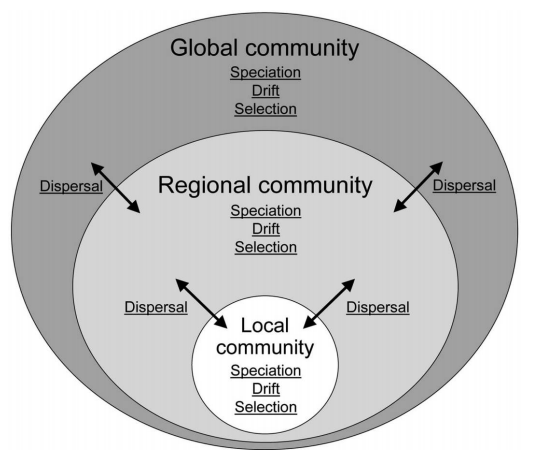 Figura 1. A teoria de ecologia de comunidades apresentada por Vellend (2010). Figura adaptada de Vellend e Orrock (2009). Fonte: (Vellend, 2010).
Figura 1. A teoria de ecologia de comunidades apresentada por Vellend (2010). Figura adaptada de Vellend e Orrock (2009). Fonte: (Vellend, 2010).
Em ecologia de comunidades, o reconhecimento de novos paradigmas ou avanços de trabalhos anteriores se torna mais fácil e visível ao organizar conceitualmente os processos que estão ligados aos padrões encontrados em diferentes comunidades (Vellend, 2010). A maneira como os processos interagem é variável e dependente das especificidades bióticas e abióticas que os desencadeiam, por isso, a dinâmica de cada comunidade estudada não deve se basear unicamente nos padrões encontrados no presente (Vellend, 2010). Outra grande contribuição desta teoria geral para ecologia de comunidades é o entendimento de que a composição e diversidade de espécies locais estão diretamente ligadas ao pool regional de espécies por meio da dispersão em diferentes escalas espaciais, e ao processo de especiação, deriva e seleção dentro de uma escala temporal (Pärtel, 2002; Vellend, 2010).
Os distúrbios fazem parte da dinâmica natural dos ecossistemas, sendo determinantes no processo de seleção das espécies que ocorrem em uma determinada comunidade, bem como, nos padrões de distribuição espaco-temporal das espécies (Beeby, 1993). Diferentes regimes de distúrbios podem implicar na entrada (input) ou saída (output) de espécies de uma comunidade direta e indiretamente, por alterar os processos de especiação e dispersão e gerar padrões como a relação entre diversidade-ambiente, diversidade-produtividade e diversidade-distúrbio, bem como o pool regional de espécies (Cardinale et al., 2005; Fridley, 2002; Grime, 1998; Hubbell et al., 1999; Ricklefs, 2004; Vellend, 2010). Regimes de distúrbios também podem gerar padrões relacionados a interação entre organismos, coexistência e flutuações na abundância de espécies e em múltiplos estados alternativos, por meio do processo de seleção (Hastings, 1980; Vellend, 2010). A seleção pode influenciar na resposta das espécies a fatores abióticos, interação direta e indireta entre organismos (competição, predação, herbivoria, etc), respostas funcionais ou comportamentais de organismos, grau de especialização em interações interespecíficas e disponibilidade dos recursos (Hastings, 1980; Hubbell et al., 1999; Ricklefs and Miller, 1999; Vellend, 2010).
Embora seja difícil de avaliar isoladamente, a deriva exerce um papel importante na comunidade, geralmente moldando a abundância relativa das espécies de maneira estocástica (Hubbell, 2001; Vellend, 2010). Quando duas espécies suficientemente próximas são competitivamente equivalentes, a deriva consegue explicar alguns padrões observados em relação a distribuição destas espécies, ou quando há variação na similaridade da composição de espécies entre comunidades próximas, independente do ambiente, a deriva pode determinar padrões na composição, abundância e riqueza de espécies (Hubbell, 2001; Vellend, 2010).
Assim, as dinâmicas das comunidades locais podem ser determinadas por cada um destes processos e pela interação entre eles, sendo que a frequência dos distúrbios pode alterar ou intensificar estes processos e suas interações na comunidade local ou regional, e em grandes escalas de tempo, podem transformar as comunidades para mais ou menos adaptadas ao distúrbio (Cottenie, 2005; Hastings, 1980; Vellend, 2010). A frequência e severidade do distúrbio altera a disponibilidade dos recursos no ecossistema, que pode limitar a produtividade primária das espécies e alterar a intensidade em que as espécies interagem, especialmente em relação às espécies competidoras (Cardinale et al., 2005; Grime, 1998; Kondoh, 2001). Os efeitos da produtividade e do distúrbio na competição são opostos, sendo que a maior produtividade favorece competidores superiores, enquanto que o aumento do nível do distúrbio favorece competidores inferiores (Kondoh, 2001).
O fogo é um distúrbio natural que ocorre em praticamente todos os biomas do mundo, e há cerca de 420 milhões de anos tem moldado paisagens em diferentes ecossistemas (Pausas & Keeley 2009, Simon et al. 2009, Bond et al. 2005, Bowman et al. 2009). Distúrbios como o fogo levam diferentes ecossistemas a processos de sucessão ecológica e regeneração da vegetação, definindo paisagens que foram caracterizadas pelo fogo por milhões de anos. Estes ecossistemas influenciam e são influenciados pelo regime do fogo (frequência, época, extensão, tipo e intensidade das queimadas) e interferem no comportamento do fogo (Whelan, 1995). O comportamento do fogo é caracterizado pela intensidade e velocidade de propagação do fogo, estes dois fatores são determinados pela disponibilidade, continuidade, características e composição do material combustível, bem como, pelas condições meteorológicas e topográficas locais no momento de queima (Birch et al., 2015; Keeley, 2009; Pyne, 2001; Rothermel, 1972; Whelan, 1995). O regime do fogo junto com o comportamento do fogo geram diferentes efeitos em populações, comunidades e ecossistemas (Iglesias et al., 2015; Miranda, 2010; Whelan, 1995).
Regimes antropogênicos do fogo normalmente alteram a composição de espécies, favorecendo aquelas mais resistentes ao fogo, cuja fisiologia e estrutura garantem um maior fitness em regimes de fogo frequentes (Bond and Midgley, 1995; Cochrane, 2009; Dantas and Pausas, 2013; Duff et al., 2013; Keeley et al., 2011). Sistemas em que o fogo é recorrente, tanto a estrutura como a composição do estrato arbóreo tende a se tornar menos complexas, aumentando a dominância do estrato graminoso-herbáceo em comparação com o arbóreo (Brown and Smith, 2000; Bush et al., 2015; Cochrane and Laurance, 2002; San José and Fariñas, 1983; Williams et al., 1999).
A dominância das gramíneas e sua permanência no estrato herbáceo em savanas pode ser explicada por mecanismos de regulação bottom-up, ou seja, pela disponibilidade de recursos (nutrientes e água) e/ou profundidade do solo; ou por mecanismos top-down especialmente pela herbivoria e ocorrência de fogo, que podem limitar o estabelecimento e crescimento de indivíduos arbóreos (Bond, 2008; Bond et al., 2004). O fogo pode ser considerado um herbívoro generalista que consume biomassa aérea de plantas sem distinção de espécies, sendo parte integrante do processo de seleção. Desta forma, alguns autores defendem que o fogo teria um papel mais importante que os herbívoros em selecionar características de adaptação nas plantas em ecossistemas pirofíticos e em especial nas savanas (Bond & Kelley 2005), sendo um importante fator no processo de especiação.
De acordo com Simon et al. (2009) as linhagens de plantas no Cerrado começaram a se diversificar menos de 4 milhões de anos atrás, que coincide com a ascensão da dominância de gramíneas C4 nas savanas de todo o mundo, e estão fortemente associadas com adaptações a distúrbios como o fogo. Os resultados deste trabalho revelam que a formação do Cerrado é recente e a composição e estrutura da vegetação é resultado de mudanças adaptativas frequentes ao fogo, e não da dispersão regional de linhagens já adaptadas ao fogo. Com este estudo, é possível inferir que o fogo foi um fator importante na seleção de espécies, assim, as espécies mais adaptadas ao fogo foram selecionadas e permaneceram no Cerrado e o processo de especiação que atuou por alguns milhões de anos contribuiu com suas linhagens.
Um estudo utilizando modelo de dinâmica da vegetação global mostra que a exclusão do fogo (distúrbio) em áreas formadas por campos úmidos de gramíneas C4 e savanas, na América do Sul e na África, pode aumentar a cobertura destas áreas por florestas fechadas em detrimento das gramíneas (Bond et al., 2005). Neste sentido, em algumas áreas onde o clima é favorável, o fogo reduz a densidade e o tamanho de plantas lenhosas, bem como a tendência sucessional de espécies sensíveis ao fogo (Bond et al., 2005). Assim, a dispersão e a seleção são importantes processos que ajudam a explicar estes resultados. A dispersão contribui no pool de espécies regional, a qual sem um regime de distúrbio possibilita a colonização de espécies sensíveis ao fogo, porém a maior produtividade das espécies lenhosas sem o fogo pode favorecer competidores superiores e dificultar a colonização de gramíneas.
Os efeitos do fogo na vegetação dependem da composição da comunidade biótica e gradientes ambientais (relevo, solo, umidade, microclima e disponibilidade de combustível) em que ocorre, assim como, do regime do fogo (Bowman et al., 2009; Whelan, 1995). Alguns exemplos dos efeitos que o fogo pode exercer sobre populações de plantas ao longo do tempo são mostrados na figura 2. Porém, muitos trabalhos que avaliam os efeitos do fogo na vegetação focam nos padrões das comunidades em análise, observados antes e pós-fogo.
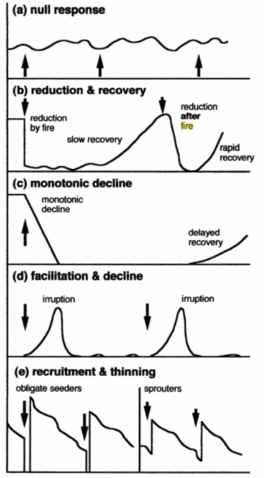 Figura 2. Diagrama esquemático ilustrando uma variedade de padrões de respostas ao fogo de populações ao longo do tempo. (a) Resposta nula – o tamanho da população não se altera em resposta ao fogo. (b) redução e recuperação – o tamanho da população diminui logo após o fogo e permanece baixa por um período seguido da recuperação (recuperação rápida versus lenta); © declínio monotônico do tamanho da população, levando a extinção local, com possibilidades de recuperação eventual; (d) facilitação e declínio – o tamanho da população aumenta após o fogo e depois declina; (e) recrutamento e estreitamento – o tamanho da população diminui dramaticamente imediatamente após o fogo, depois aumenta rapidamente, seguido de declínio gradual, para espécies que obrigatoriamente semeiam (esquerda) e espécies que rebrotam (direita). Fonte: Whelan et al. (2002).
Figura 2. Diagrama esquemático ilustrando uma variedade de padrões de respostas ao fogo de populações ao longo do tempo. (a) Resposta nula – o tamanho da população não se altera em resposta ao fogo. (b) redução e recuperação – o tamanho da população diminui logo após o fogo e permanece baixa por um período seguido da recuperação (recuperação rápida versus lenta); © declínio monotônico do tamanho da população, levando a extinção local, com possibilidades de recuperação eventual; (d) facilitação e declínio – o tamanho da população aumenta após o fogo e depois declina; (e) recrutamento e estreitamento – o tamanho da população diminui dramaticamente imediatamente após o fogo, depois aumenta rapidamente, seguido de declínio gradual, para espécies que obrigatoriamente semeiam (esquerda) e espécies que rebrotam (direita). Fonte: Whelan et al. (2002).
É importante ressaltar que os efeitos do fogo sobre a vegetação também estão associados a mudanças nas combinações entre os processos de seleção, deriva, especiação e dispersão, que atuam na dinâmica das comunidades de plantas de maneiras diferentes (Figura 3), tanto na escala local como regional (Vellend, 2010). A escala de tempo não deve ser apenas aquela perceptível ao homem, mas o histórico e previsões para o futuro são essenciais para entender a dinâmica de comunidades (Vellend, 2010). A teoria geral de ecologia de comunidades desenvolvida por Vellend (2010) permite um melhor entendimento dos processos que atuam sobre as possíveis respostas da dinâmica de comunidades de plantas a diferentes frequências, intensidades e épocas de ocorrência do fogo, ou seja, dos padrões gerados nas comunidades observadas.
 Figura 3. Possíveis efeitos do regime de fogo em comunidades de plantas em ecossistemas pirofíticos, no contexto da teoria síntese de ecologia de comunidades. Figura adaptada de Vellend (2010).
Figura 3. Possíveis efeitos do regime de fogo em comunidades de plantas em ecossistemas pirofíticos, no contexto da teoria síntese de ecologia de comunidades. Figura adaptada de Vellend (2010).
Referências bibliográficas
Beeby, A., 1993. Applying ecology. Chapman & Hall, London, UK.
Birch, D.S., Morgan, P., Kolden, C.A., Abatzoglou, J.T., Dillon, G.K., Hudak, A.T., Smith, A.M.S., 2015. Vegetation , topography and daily weather influenced burn severity in central Idaho and western Montana forests. Ecosphere 6, 1–23.
Bond, W.J., Midgley, J.J., 1995. Kill thy neighbour : an individualistic argument for the evolution of flammability. Oikos 73, 79–85.
Bond, W.J., Woodward, K.I., Midgley, G.E., 2005. The global distribution of ecosystems in a world without fire. New Phytol. 165, 525–538.
Bowman, D.M.J.S., Balch, J.K., Artaxo, P., Bond, W.J., Carlson, J.M., Cochrane, M.A., Antonio, C.M.D., Defries, R.S., Doyle, J.C., Harrison, S.P., Johnston, F.H., Keeley, J.E., Krawchuk, M.A., Kull, C.A., Marston, J.B., Moritz, M.A., Prentice, I.C., Roos, C.I., Scott, A.C., Swetnam, T.W., Werf, G.R. Van Der, Pyne, S.J., 2009. Fire in the Earth System. Science. 324, 481–484.
Brown, J.K., Smith, J.K., 2000. Wildland fire in ecosystems effects of fire on flora, JFSP Synthesis Reports. Lincoln. doi:10.1111/j.1467-7717.2009.01106.x
Bush, M.B., Alfonso-reynolds, A.M., Urrego, D.H., Valencia, B.G., Correa-metrio, Y.A., Zimmermann, M., Silman, M.R., 2015. Fire and climate : contrasting pressures on tropical Andean timberline species. J. Biogeogr. 1–13. doi:10.1111/jbi.12470
Cardinale, B.J., Palmer, M.A., Ives, A.R., Brooks, S.S., 2005. Diversity-productivity relationships in streams vary as a function of the natural disturbance regime. Ecology 86, 716–726. doi:10.1890/03-0727
Cochrane, M. A., Laurance, W.F., 2002. Fire as a large-scale edge effect in Amazonian forests. J. Trop. Ecol. 18, 311–325. doi:10.1017/S0266467402002237
Cochrane, M. A., 2009. Tropical fire ecology:climate change, land use, and ecosystem dynamics. Springer-Praxis, Heidelberg, Germany.
Cottenie, K., 2005. Integrating environmental and spatial processes in ecological community dynamics. Ecol. Lett. 8, 1175–1182. doi:10.1111/j.1461-0248.2005.00820.x
Dantas, V. D. L., Pausas, J.G., 2013. The lanky and the corky : fi re-escape strategies in savanna woody species. J. Ecol. 101, 1265–1272. doi:10.1111/1365-2745.12118
Duff, T.J., Bell, T.L., York, A., 2013. Managing multiple species or communities? Considering variation in plant species abundances in response to fire interval, frequency and time since fire in a heathy Eucalyptus woodland. For. Ecol. Manage. 289, 393–403. doi:10.1016/j.foreco.2012.10.032
Fridley, J.D., 2002. Resource availability dominates and alters the relationship between species diversity and ecosystem productivity in experimental plant communities. Oecologia 132, 271–277. doi:10.1007/s00442-002-0965-x
Grime, J.P., 1998. Benefits of plant diversity to ecosystems: immediate, filter and founder effects. J. Ecol. 86, 902–910.
Hastings, A., 1980. Disturbance, coexistence, history, and competition for space. Theor. Popul. Biol. 18, 363–373. doi:10.1016/0040-5809(80)90059-3
Hubbell, S.P., 2001. The unified neutral theory of biodiversity and biogeography. Princeton University Press, Princeton.
Hubbell, S.P., Foster, R.B., O’Brien, S.T., Harms, K.E., Condit, R., Wechsler, B., Wright, S.J., Loo de Lao, S., 1999. Light-gap disturbances, recruitment limitation, and tree diversity in a Neotropical forest. Science (80-. ). 283, 554–557. doi:10.1126/science.283.5401.554
Iglesias, V., Yospin, G.I., Whitlock, C., 2015. Reconstruction of fire regimes through integrated paleoecological proxy data and ecological modeling. Front. Plant Sci. 5, 1–17. doi:10.3389/fpls.2014.00785
Keeley, J.E., 2009. Fire intensity , fire severity and burn severity : a brief review and suggested usage. Int. J. Wildl. Fire 18, 116–126.
Keeley, J.E., Pausas, J.G., Rundel, P.W., Bond, W.J., Bradstock, R.A., 2011. Fire as an evolutionary pressure shaping plant traits. Trends Plant Sci. 16, 406–411. doi:10.1016/j.tplants.2011.04.002
Kondoh, M., 2001. Unifying the relationships of species richness to productivity and disturbance. Proc. R. Soc. B Biol. Sci. 268, 269–271. doi:10.1098/rspb.2000.1384
Miranda, H.S., 2010. Efeitos do regime de fogo sobre a estrutura de comunidades de cerrado: Resultados do projeto fogo. MMA, IBAMA, Brasília, DF.
Morin, P.J., 1999. Community ecology. Blackwell Science, Oxford.
Pärtel, M., 2002. Local plant diversity patterns and evolutionary history at the regional scale. Ecology 83, 2361–2366.
Pyne, S.J., 2001. Fire: a brief history. University of Washington Press, Seattle, WA.
Ricklefs, R.E., 2004. A comprehensive framework for global patterns in biodiversity. Ecol. Lett. 7, 1–15. doi:10.1046/j.1461-0248.2003.00554.x
Ricklefs, R.E., Miller, G.L., 1999. Ecology, 4th ed. W. H. Freeman, New York.
Rothermel, R.C., 1972. A mathematical model for predicting fire spread in wildland fuels. USDA For. Serv. Res. Pap. INT USA 48.
San José, J. J., Fariñas, M.. R.., 1983. Changes in Tree Density and Species Composition in a Protected Trachypogon Savanna , Venezuela. Ecology 64, 447–453.
Simon, M.F., Grether, R., Queiroz, L.P., Skema, C., Pennington, R.T., Hughes, C.E., 2009. Recent assembly of the Cerrado, a neotropical plant diversity hotspot, by in situ evolution of adaptations to fire. Proc. Natl. Acad. Sci. 106. doi:20359-20364
Vellend, M., 2010. Conceptual synthesis in community ecology. Q. Rev. Biol. 85, 183–206. doi:10.1086/652373
Whelan, R.J., 1995. The ecology of fire. Cambridge University Press, Cambridge.
Whelan, R.J., Rodgerson, L., Dickman, C.R., Sutherland, E.F., 2002. Critical life cycles of plants and animals: developing a process-based understanding of population changes in fire-prone landscapes, in: Bradstock, R.A., Williams, J.E., Gill, M.A. (Eds.), Flammable Australia: The Fire Regimes and Biodiversity of a Continent. Cambridge University Press, Cambridge, pp. 94–124.
Williams, R.J., Cook, G.D., Gill, A.M., Moore, P.H.R., 1999. Fire regime , fire intensity and tree survival in a tropical savanna in northern Australia. Aust. J. Ecol. 24, 50–59.
Padrões de riqueza de espécies e processos históricos que atuam promovendo diversidade em gradientes altitudinais
Joice Iamara Nogueira
Um dos principais padrões biológicos bem reconhecido e estudado é a variação na riqueza de espécies em gradientes latitudinais (Willig et al. 2003; Wiens et al. 2007). Esse padrão permanece consistente independente do táxon, contexto geográfico ou tempo evolutivo (Willig et al. 2003). No entanto, a riqueza de espécies também possui um padrão de variação altitudinal, que tem recebido menos atenção mas que pode ser mais relevante em termos de conservação em limites políticos e/ou regionais (Wiens et al. 2007).
As primeiras evidências acerca desse padrão resultaram de uma generalização de dois estudos da década de 70 com aves tropicais (Kikkawa and Williams, 1971; Terborgh 1977), que demonstram que a riqueza de espécies diminui de forma monotomica com a altitude (Fig. 1A). No entanto, esses trabalhos ou foram coletados de forma pouco sistemática (Kikkawa and Williams, 1971) ou apresentavam viés de amostragem devido à biologia das aves e à limitação de captura (Terborgh 1977). O refinamento dos dados deste trabalho e estudos posteriores demonstram que padrão altitudinal mais comumente observado é uma riqueza relativamente menor em baixas altitudes, alta em altitudes intermediárias e muito menor em grandes altitudes (Rahbek 1995; Mccain 2005; Oommen and Shanker 2005), descrevendo assim um padrão “hump-shaped” (Fig. 1B). Apesar da maioria dos trabalhos apresentarem este padrão, há evidencias de que o pico de diversidade pode depender de escalas espaciais, sendo que escalas menores podem apresentar padrões bimodais ou monotonicos (Oommen and Shanker 2005).
Por Rahbeck (1995)
Diversos trabalhos associam essa variação na riqueza de espécies com altitude a fatores ambientais, tanto abióticos como efeito de área, pluviosidade e temperatura (Rahbek 1995; Mccain 2005; Oommen and Shanker 2005; Aridas 2014), quanto fatores bióticos, como a competição, abundância de recursos e produtividade (Mccain 2005; Aridas 2014). Estes fatores podem, de fato, desempenhar um papel importante no número de espécies, mas a riqueza é, em última instância, determinada pelos três fatores que mudam o número de espécies em comunidades: especiação, extinção e dispersão (Wiens et al. 2007).
Há duas hipóteses gerais para explicar os padrões de riqueza com a variação altitudinal. A primeira delas sugere que a heterogeneidade espacial em áreas de montanhas promove taxas maiores de especiação e menores de extinção (Moritz et al. 2000; Rahbek and Graves 2001), podendo ainda ocorrer taxas altas de especiação em altitudes com maior número de espécies e taxas altas de extinção em altitudes com menor número de espécies (Wiens et al. 2007). A segunda hipótese sugere que não há diferenças nas taxas de especiação entre altitudes, mas áreas que foram colonizadas há mais tempo podem apresentar maior riqueza, pois houve maiores chances de ocorrer eventos de especiação nessas localidades (Stephens and Wiens 2003; Wiens et al. 2007). A combinação de dados filogenéticos, de limites altitudinais na distribuição das espécies e do tempo estimado de divergência das espécies pode elucidar qual dessas duas hipóteses está agindo para promover o padrão observado, embora poucos trabalhos que usam esse método tenham sido realizados (Wiens et al. 2007).
Uma parte do meu projeto de pesquisa consiste em comparar a composição florística associada ao grupo beija-flores mais comuns que atuam como polinizadores em comunidades com diferentes altitudes situadas na Mata Atlântica. As duas primeiras localidades estão situadas na Serra do Mar, sendo uma região costeira ao nível do mar, Caraguatatuba (50 – 100 m elev.) e uma região de altitude, Cunha (1000 – 1100 m elev.). A terceira localidade situada na Serra da Mantiqueira, Campos do Jordão, é também uma região de altitude (1400 – 1600 m elev.) (Buzato et al. 2000).
De acordo com levantamentos prévios (Buzato et al. 2000), as áreas de estudo possuem 86 espécies de plantas polinizadas por beija-flores, sendo de 25 famílias e 44 gêneros, sendo Bromeliaceae a principal família, contendo cerca de 36% das espécies. No entanto, a riqueza de espécies varia com a altitude, sendo que regiões com baixa altitude apresentam riqueza ligeiramente maior, média em altitudes médias e menor em altitudes maiores (Tabela 1). Com relação aos polinizadores, foram registradas 15 espécies de beija-flores nas três áreas, apresentando a mesma variação de riqueza conforme a altitude observada na comunidade vegetal (Tabela 2).
Por Buzato et al. (2000)
Ao contrário da maioria dos estudos realizados com divergência de riqueza em relação a altitude, o padrão observado nas áreas de estudo foi monotônio e não o “hump-shaped”. Frente a essa nova informação, uma nova preocupação que irei ter no meu Doutorado será refinar os dados encontrados. Assim como Terborgh (1977), os dados coletados por Buzato et al. (2000) podem estar enviesados por outros fatores, tais como tamanho da área, métodos de observações focais (para beija-flores) ou outros motivos não considerados no desenho experimental prévio. Controlando possíveis fatores que possam intervir no padrão de riqueza, irei comparar se o padrão encontrado previamente se mantém.
A explicação sugerida pelos autores para explicar as diferenças na riqueza entre as áreas é principalmente a escassez em ervas terrestres e arbustos (Buzato et al. 2000). No entanto, não há evidencias de qual processo estaria agindo para promover essas diferenças. A utilização de filogenias poderia esclarecer se alguma das hipóteses acimas citadas (taxas de diferenciação ou tempo de colonização) estaria contribuindo para as diferenças entre as altitudes. Como o sistema se trata de coespeciação, filogenias comparadas da comunidade vegetal e dos beija-flores que as polinizam, juntamente com os limites de distribuição das espécies, poderiam fornecer dados ainda mais esclarecedores para os padrões observados.
Referências Bibliográficas
Aridas, Z. 2014. Elevation patterns in rodent diversity in the dry Andes: disentangling the role of environmental factors. J. Mammal. 95:99–107.
Buzato, S., M. Sazima, and I. Sazima. 2000. Hummingbird-Pollinated Floras at Three Atlantic Forest Sites. Biotropica 32:824–841.
Kikkawa, J., and E. E. Williams,. 1971. Altitude distribution of land birds in New Guinea. Search 2:64–65.
Mccain, C. M. 2005. Elevational Gradients in Diversity of Small Mammals. Ecology 86:366–372.
Moritz, C., J. L. Patton, C. J. Schneider, and T. B. Smith. 2000. Diversification of Rainforest Faunas: An Integrated Molecular Approach. Annu. Rev. Ecol. Syst. 31:533–563.
Oommen, M., and K. Shanker. 2005. Elevational Species Richness Patterns Emerge from Multiple Local Mechanisms in Himalayan Woody Plants. Ecology 86:3039–3047.
Rahbek, C. 1995. The Elevational Gradient of Species Richness: A Uniform Pattern? Ecography 18:200–205.
Rahbek, C., and G. R. Graves. 2001. Multiscale assessment of patterns of avian species richness. Proc. Natl. Acad. Sci. U. S. A. 98:4534–4539.
Stephens, P. R., and J. J. Wiens. 2003. Explaining Species Richness from Continents to Communities: The Time-for-Speciation Effect in Emydid Turtles. Am. Nat. 161:112–128.
Terborgh, J. 1977. Bird Species Diversity on an Andean Elevational Gradient. Ecology 58:1007–1019.
Wiens, J. J., G. Parra-Olea, M. García-París, and D. B. Wake. 2007. Phylogenetic history underlies elevational biodiversity patterns in tropical salamanders. Proc. Biol. Sci. 274:919–28.
Willig, M. R., D. M. Kaufman, and R. D. Stevens. 2003. Latitudinal Gradients of Biodiversity: Pattern, Process, Scale, and Synthesis. Annu. Rev. Ecol. Evol. Syst. 34:273–309.
"Só valorizamos quando perdemos"-Transições críticas e estados alternativos aplicados à atitude em relação à preservação florestal
Karina Campos Tisovec Dufner
A partir das décadas de 1960 e 70, muitos ecólogos buscaram nas teorias dos sistemas dinâmicos, regras mais gerais que ajudassem na compreensão dos padrões observados na natureza (Berryman, 1989; Scheffer, 2009). A resposta de um sistema dinâmico à uma variável externa nem sempre é gradual e previsível (figura 1a), ou com limiares simples (figura 1b). Na verdade, pode existir um tipo de limiar muito mais extremo caracterizado por uma transição crítica ou catastrófica (figura 1c) quando uma pequena mudança das condições causa uma grande alteração do estado final (Scheffer, 2009; Walker & Meyers, 2004). A descoberta de transições abruptas trouxe algumas complicações pois, as equações de Lokta-Volterra muito usadas na descrição da dinâmica de duas espécies e outros modelos matemáticos baseados em equações diferenciais, precisavam de alguma forma incorporar essas descontinuidades das respostas para se tornarem mais realistas (Holling, 1973; Zeeman, 1976). A teoria da catástrofe, originalmente desenvolvida por René Thom, justamente tentou descrever situações onde as mudanças não são graduais (e.g. a mudança do comportamento agressivo de cães, discussões humanas e estados mentais de indivíduos com anorexia) (Zeeman, 1976). Um dos conceitos centrais na teoria de transições críticas são os pontos de equilíbrio de um sistema, ou seja, quando ele se encontra em um estado estável no qual existe um atrator que age como um imã (Zeeman, 1976), atraindo-o de volta (i.e. setas da figura 1) caso ocorra uma perturbação ou flutuações nas condições externas (Scheffer, 2009). Para um sistema ecológico que responde de forma gradual ou com limiar simples à variação ambiental existe apenas um estado de equilíbrio possível em cada condição (Scheffer, 2009). Já no caso de uma resposta catastrófica se forma uma dobra que determina três estados alternativos sob uma mesma faixa de condições, sendo dois deles estáveis e um instável (i.e. ponto de repulsão), de modo que a partir dos pontos de bifurcação (i.e. F1 e F2) o comportamento do sistema se torna bimodal (Scheffer, 2009; Zeeman, 1976). Vale lembrar que muitas vezes quando estudamos um sistema ele está em um momento de transição, longe de seus atratores teóricos (Scheffer, 2009).
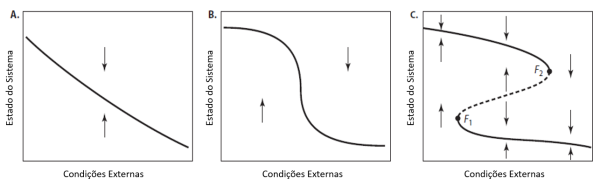
As possíveis mudanças entre estados de um sistema ecológico estão intimamente ligadas a dois conceitos bastante importantes: a estabilidade e a resiliência. A estabilidade dá mais ênfase aos pontos de equilíbrio, podendo ser global ou local, caso existam um ou múltiplos estados estáveis, respectivamente (Holling, 1973). A paisagem de estabilidade é um modelo gráfico que mostra analogias com bacias ou vales para os estados estáveis (i.e. atrator) e picos ou montes para os instáveis. Apesar de ser uma figura muito difundida em artigos e livros, Scheffer (2009) chama atenção para a cautela que é preciso ter ao interpretá-la. No caso da resiliência (i.e. largura da bacia de atração), o foco maior está nas transições, medindo a habilidade do sistema de absorver um distúrbio e manter a mesma relação entre as variáveis (Holling, 1973), ou seja, sem mudar de estado. Atualmente é possível encontrar outras definições para o conceito de resiliência que buscaram incorporar outras propriedades importantes, além de aspectos sociais envolvidos (e.g. capacidade do sistema de absorver um distúrbio e se reorganizar enquanto passa por uma mudança, de modo a reter essencialmente a mesma função, estrutura, identidade e feedbacks) (Carl Folke, 2006; Scheffer, 2009).
Os feedbacks são mecanismos essenciais para compreender a comportamento do sistema e ocorrem quando um estímulo retorna novamente até sua origem, influenciando-a, por meio de interações (Berryman, 1989). No geral, feedbacks negativos que apresentam uma relação inversa entre os fatores (e.g. dinâmicas de predador-presa) tendem a estabilizar o sistema e predominam dentro das bacias de atração, enquanto que os positivos (e.g. vegetação e umidade local), por amplificarem um estímulo inicial, podem promover a existência de estados alternativos, causando instabilidades e prevalecendo nos picos das paisagens de estabilidade (Berryman, 1989; Runyan, D'Odorico, & Shobe, 2015; Scheffer, 2009). Na realidade os dois tipos de feedbacks estão presentes na maioria dos sistemas ecológicos tornando as relações ainda mais complexas (Berryman, 1989), soma-se a isso o fato de mesmo quando um limiar é ultrapassado, causando uma alteração na relação dos feedbacks, a velocidade com que se dão consequências pode variar (e.g. rápida em lagos e devagar para a vegetação terrestre) (Walker & Meyers, 2004).
O conhecimento acerca das transições críticas ajudou muitos ecólogos a compreender o funcionamento de sistemas nos quais foram observadas mudanças abruptas de estados estáveis (e.g. turbidez em lagos, vegetação de ecossistemas terrestres, alterações climáticas e de estoques pesqueiros, mudança nos oceanos de corais e florestas de kelps, surtos de pragas, infecções e epidemias) e também de casos mais complexos onde existem variações dos estados dentro de ciclos limites (e.g. ciclos de predador-presa e surtos de insetos conhecidos como spruce budworms que atacam coníferas) (Blindow, Andersson, Hargeby, & Johansson, 1993; Holling, 1973; May, 1977; Scheffer, 2009). Também já foram descritas mudanças bruscas (e.g. guerras, crises econômicas, revoluções científicas) e estados alternativos (e.g. riqueza e pobreza) em sistemas sociais, onde o papel do aprendizado, disseminação da informação e inovações têm papeis muito importantes para a dinâmica e contribuem para uma maior capacidade adaptativa frente à mudanças (Scheffer, 2009). Atualmente está cada vez mais evidente a necessidade de se expandir as escalas de estudo considerando de forma interdisciplinar os componentes sociais (humanos) e ecológicos dentro de sistemas sócio-ecológicos (Chapin et al., 2006; Edwards & Abivardi, 1998; C. Folke et al., 2002; Hull, Tuanmu, & Liu, 2015; Liu et al., 2007), também conhecidos como CHANS (do inglês, Coupled Human And Natural Systems). Tais sistemas apresentam alta complexidade em suas relações (C. Folke et al., 2002; Liu et al., 2007; Walker & Meyers, 2004) envolvendo diferentes escalas temporais (e.g. dias a séculos) e espaciais (e.g. local à global) (Chapin et al., 2006; Filotas et al., 2014), tendo sido estudados por exemplo em regiões agrícolas, florestais e urbanas (Hull et al., 2015). Pode-se considerar que se por um lado, o ser humano altera e influencia o componente ecológico, através do uso de recursos naturais e modificações no uso do solo. Por outro lado, a alteração do componente ecológico afeta o componente social, uma vez que a perda de biodiversidade e outras alterações nos ecossistemas podem resultar na diminuição ou perda de serviços ecossistêmicos (Carpenter et al., 2009; McCauley, 2006) e consequentemente prejudicar o bem-estar humano ou os benefícios socioeconômicos (FAO, 2014).
Como os sistemas estão sujeitos às incertezas do futuro e eventos estocásticos, um manejo centrado apenas na estabilidade seria muito estático, sendo mais recomendado usar a perspectiva da resiliência que foca mais nas transições entre os domínios de atração e na necessidade de persistência (Carl Folke, 2006; Holling, 1973). Modelos de extração de recursos mostram que dependendo da taxa de consumo podem existir diferentes estados estáveis, assim como um tradeoff pois, aumentando a taxa máxima de produção até o ótimo possível, também se eleva a chance de um colapso (Holling, 1973; May, 1977; Scheffer, 2009), da mesma forma como ocorre quando não existe um comportamento cooperativo entre um grupo social que usa um recurso comum (Runyan et al., 2015). Sendo assim, é melhor extrair a uma taxa menor e garantir a possibilidade de extração por mais tempo, adotando uma postura de precaução (Carl Folke, 2006; May, 1977; Scheffer, 2009). Um dos principais problemas em relação ao manejo de um sistema é que não vemos quando um limiar crítico está se aproximando, as mudanças graduais das condições ambientais vão diminuindo a resiliência de forma invisível (Holling, 1973; Scheffer, 2009), embora existam alguns indicativos não definitivos que podem servir de alerta (e.g. recuperação lenta a pequenos distúrbios ou aumento da variância de flutuações) (Scheffer et al., 2009). Desse modo, assumir a inexistência de pontos de virada quando de fato eles existem (i.e. um falso negativo) pode ser muito perigoso (Scheffer, 2009). Além disso, no caso de mudanças catastróficas pode existir uma situação de histerese (Zeeman, 1976), para a qual a reversão ao estado inicial exigirá uma diminuição muito maior da variável externa, além do ponto que desencadeou a mudança, o que em geral é muito difícil e custoso (Scheffer, 2009). Apesar de todas as limitações, já existem casos onde o conhecimento adquirido foi usado tanto para prevenir ou alterar mudanças indesejadas (e.g. colapso de populações de bacalhaus e outros peixes, turbidez em lagos usados para recreação, aumento da resiliência na Grande Barreira de Corais) (Persson et al., 2007; Scheffer, 2009), como para promover mudanças positivas (e.g. restauração de ecossistemas e disponibilização de microcrédito para pessoas com baixa renda) (Scheffer, 2009). Uma das estratégias mais recentes usadas no manejo, descrita por Holling em 1986, é a Teoria do Ciclo de Renovação Adaptativo, um modelo heurístico contendo quatro fases de diferentes velocidades (e.g. exploração, conservação, liberação e reorganização) que se repetem e se intercalam entre diferentes escalas dos sistemas, enfatizando a importância dos distúrbios para o processo de desenvolvimento (Carl Folke, 2006; Scheffer, 2009).
Dentro dessa temática, meu projeto de mestrado, a partir da perspectiva dos sistemas sócio-ecológicos, tem como objetivo (i) compreender de que maneira o contexto ambiental em que as pessoas vivem, e os (ii) serviços e benefícios que recebem das florestas, influenciam a atitude em relação à preservação dos remanescentes florestais. Segundo a Teoria do Comportamento Planejado (Ajzen, 1987, 1991), a execução de um comportamento (e.g. preservar a floresta) é influenciado pela atitude (i.e. apreciação favorável ou não favorável) que o indivíduo tem em relação a este comportamento (e.g. preservar a floresta é bom ou correto). A atitude é definida pelas crenças que dizem respeito aos resultados ou atributos associados ao comportamento (e.g. preservar a floresta traz benefícios para a purificação da água) (Ajzen, 1987, 1991). É de se esperar que exista um feedback positivo entre o contexto em que uma pessoa vive e sua atitude em relação a preservar a floresta. Assim, pessoas que vivem em paisagens mais florestadas teriam mais contato com esses ecossistemas e se beneficiariam mais dos serviços providos por eles, o que poderia levá-las a valorizar mais (i.e. ter crenças positivas relacionadas à utilidade da floresta) e portanto ter uma atitude mais favorável com relação às florestas, consequentemente preservando mais os remanescentes de suas propriedades. Compreender a relação e força conjunta dos feedbacks entre homem-natureza é extremamente importante, pois a maioria dos estudos já feitos focam apenas em um desses componentes (Hull et al., 2015) e caso essas interações sejam fortes o suficiente podem surgir respostas catastróficas (Scheffer, 2009).
A teoria das transições críticas e estados alternativos pode ajudar a entender como se altera a atitude pessoal à medida que a porcentagem de cobertura florestal na paisagem muda. A resposta que um estado (i.e. neste caso a atitude pessoal) pode apresentar em relação às mudanças externas (i.g. cobertura florestal na paisagem), na verdade, pode variar entre um contínuo desde mudanças graduais até as catastróficas, caso estejam agindo também outros parâmetros reguladores (figura 2) (Scheffer, 2009; Zeeman, 1976).
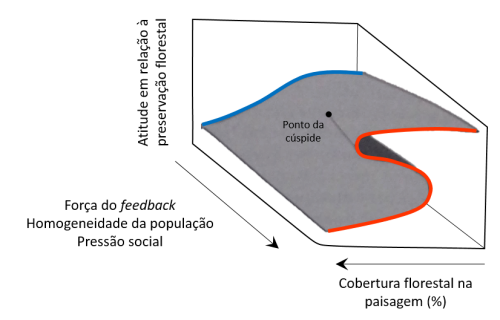
Por estar a atitude ligada à mente humana, ela poderia ficar presa em estados contrastantes, determinando uma inércia às mudanças do meio (Scheffer, 2009). Além disso, o fato das pessoas viverem em comunidades incorpora um segundo tipo de inércia, pois um indivíduo tende a mudar de atitude somente quando grande parte do grupo social já mudou primeiro e são poucas as pessoas que conseguem exercer um papel de catalizadores e promover uma avalanche na mudança de atitude (Scheffer, 2009). A opinião das pessoas também pode apresentar comportamento com histerese quando a pressão social é grande, se a variação entre indivíduos é baixa (Scheffer, 2009) ou quando há variedade nos tipos de valores dados à vegetação por grupos sociais diferentes (Runyan et al., 2015). Seria possível imaginar então uma situação na qual haveria duas dobras catastróficas, determinando três estados estáveis (figura 3). No primeiro, as pessoas teriam uma atitude favorável à preservação, pois a grande quantidade de floresta favoreceria um maior contato e uso dos benefícios florestais. Com o avanço do desmatamento as pessoas perderiam esse vínculo e suas crenças positivas em relação à preservação da mata, mudando para uma atitude desfavorável (i.e. segundo estado estável). Somente quando restasse tão pouca floresta que os serviços ecossistêmicos florestais fossem perdidos, as pessoas poderiam revalorizar a floresta, mudando para um terceiro estado estável. Como já diz o velho ditado: “você só dá valor quando perde“!

Referências bibliográficas
Ajzen, I. (1987). Attitudes, Traits, and Actions - Dispositional Prediction of Behavior in Personality and Social-Psychology. Advances in Experimental Social Psychology, 20, 1-63.
Ajzen, I. (1991). The Theory of Planned Behavior. Organizational Behavior and Human Decision Processes, 50(2), 179-211.
Berryman, A. A. (1989). The Conceptual Foundations of Ecological Dynamics. Bulletin of the Ecological Society of America, 70(4), 230-236.
Blindow, I., Andersson, G., Hargeby, A., & Johansson, S. (1993). Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology, 30(1), 159-167.
Carpenter, S. R., Mooney, H. A., Agard, J., Capistrano, D., Defries, R. S., Diaz, S., . . . Whyte, A. (2009). Science for managing ecosystem services: Beyond the Millennium Ecosystem Assessment. Proc Natl Acad Sci U S A, 106(5), 1305-1312.
Chapin, F. S., 3rd, Lovecraft, A. L., Zavaleta, E. S., Nelson, J., Robards, M. D., Kofinas, G. P., . . . Naylor, R. L. (2006). Policy strategies to address sustainability of Alaskan boreal forests in response to a directionally changing climate. Proc Natl Acad Sci U S A, 103(45), 16637-16643.
Edwards, P. J., & Abivardi, C. (1998). The value of biodiversity: Where ecology and economy blend. Biological Conservation, 83(3), 239-246.
FAO, F. a. A. O. o. U. N. (2014). State of the World’s Forests: Enhancing the socioeconomic benefits from forests.
Filotas, E., Parrott, L., Burton, P. J., Chazdon, R. L., Coates, K. D., Coll, L., . . . Messier, C. (2014). Viewing forests through the lens of complex systems science. Ecosphere, 5(1), art1.
Folke, C. (2006). Resilience: The emergence of a perspective for social–ecological systems analyses. Global Environmental Change, 16(3), 253-267.
Folke, C., Carpenter, S., Elmqvist, T., Gunderson, L., Holling, C. S., & Walker, B. (2002). Resilience and sustainable development: building adaptive capacity in a world of transformations. Ambio, 31(5), 437-440.
Holling, C. S. (1973). Resilience and Stability of Ecological Systems. Annual Review of Ecology and Systematics, 4(1), 1-23.
Hull, V., Tuanmu, M.-N., & Liu, J. (2015). Synthesis of human-nature feedbacks. Ecology and Society, 20(3).
Liu, J., Dietz, T., Carpenter, S. R., Folke, C., Alberti, M., Redman, C. L., . . . Provencher, W. (2007). Coupled Human and Natural Systems. AMBIO: A Journal of the Human Environment, 36(8), 639-649.
May, R. M. (1977). Thresholds and breakpoints in ecosystems with a multiplicity of stable states. Nature, 269(5628), 471-477.
McCauley, D. J. (2006). Selling out on nature. Nature, 443(7107), 27-28.
Persson, L., Amundsen, P. A., De Roos, A. M., Klemetsen, A., Knudsen, R., & Primicerio, R. (2007). Culling prey promotes predator recovery–alternative states in a whole-lake experiment. Science, 316(5832), 1743-1746.
Runyan, C. W., D'Odorico, P., & Shobe, W. (2015). The economic impacts of positive feedbacks resulting from deforestation. Ecological Economics, 120, 93-99.
Scheffer, M. (2009). Critical Transitions in Nature and Society: Princeton University Press.
Scheffer, M., Bascompte, J., Brock, W. A., Brovkin, V., Carpenter, S. R., Dakos, V., . . . Sugihara, G. (2009). Early-warning signals for critical transitions. Nature, 461(7260), 53-59.
Walker, B., & Meyers, J. A. (2004). Thresholds in Ecological and Social-Ecological Systems: a Developing Database. Ecology and Society, 9(2), art3.
Zeeman, E. C. (1976). Catastrophe Theory. Scientific American, 65-70, 75-83.
Seres humanos e animais silvestres: coexistência ou co-ocorrência?
Lucas Teixeira
Apesar de um grande desenvolvimento teórico e empírico baseado em processos como dispersão, deriva e especiação (MacArthur e Wilson 1963, Ricklefs 1987, Hubbell 2001), o papel da competição interespecífica na estruturação de comunidades foi, e ainda é, objeto de grande interesse dos ecólogos (Elton e Miller 1946, Hutchinson 1959, Connel 1961, Paine 1966, MacArthur e Levins 1967, Tilman 1982, Chase e Leibold 2003, Godoy et al. 2009). Entende-se por competição interespecífica a interação ecológica entre espécies diferentes, seja através da exploração de recursos comuns, seja por interferência direta (Schoener 2009), na qual as espécies têm seu fitness, aqui entendido como taxas de crescimento populacional e eficiência no uso de recursos (HilleRisLamber et al. 2012), afetado negativamente. Dois resultados alternativos são possíveis quando espécies competem por recursos: a exclusão competitiva, definida como a condição na qual uma espécie deixa de existir localmente devido à competição com uma espécie mais forte; e a coexistência estável, definida como a persistência em longo prazo de espécies competidoras (Dybzinski e Tilman 2009).
A partir dos clássicos experimentos de Gause (1934), diversos pesquisadores têm apresentado possíveis mecanismos que poderiam promover a coexistência de competidores numa comunidade. O particionamento de nicho (Hutchinson 1959, MacArthur e Levins 1967), diferenças na eficiência do uso de recursos limitantes (Tilman 1982) ou na tolerância a um inimigo comum às espécies (Lubchenco 1978, Holt e Lawton 1994), a heterogeneidade espacial e temporal na distribuição dos recursos e das condições ambientais (Chesson 2000a, Amarasekare 2003) e a capacidade de dispersão das espécies (Loreau e Mouquet 1999) são exemplos de mecanismos presentes na literatura. Seguindo uma tentativa de entender melhor e reunir estes mecanismos, alguns pesquisadores propuseram algumas teorias mais gerais para a coexistência. Por exemplo, Tilman (1982) propõe que, quando as espécies estão competindo por um recurso limitante, a espécie com maior fitness, ou seja, a espécie que for mais eficiente no uso do recurso, mantendo taxas de crescimento populacional positivas quando a disponibilidade do recurso é baixa, deve excluir competitivamente a outra. Esta regra é conhecida como regra R*: quanto menor o valor de R*, melhor competidora a espécie. Mecanismos que promovem a coexistência seriam aqueles que contrapõem tal regra, aumentando a força da competição intraespecífica em relação à competição interespecífica (Chesson 2000b, Amarasekare 2009), uma propriedade comum que retoma os princípios da teoria matemática de Lotka-Volterra. Mais recentemente, Chesson (2000b) propõe uma teoria para a manutenção da diversidade incorporando modelos matemáticos e levando em conta mecanismos comuns entre as diferentes ideias propostas na literatura, na qual ele classifica tais mecanismos em equalizadores (aqueles que diminuem a diferença de fitness das espécies, responsáveis pela exclusão competitiva), e estabilizadores (aqueles que aumentam a força da competição intraespecífica em relação à interespecífica).
Todos estes mecanismos de coexistência estudados levam em consideração apenas as relações de competição em comunidades formadas principalmente por microrganismos, animais ou plantas em sistemas ecológicos, sem incluir o papel ecológico do ser humano. Entretanto, a espécie humana também compete com os animais por espaço e recursos (Knight 2000), já tendo transformado aproximadamente a metade da porção terrestre livre de gelo em áreas urbanas, agrícolas ou de pastagens (Chapin et al. 2000, Foley et al. 2005). O crescimento da população humana e os impactos associados, como a perda de habitat, diminuem os recursos para animais silvestres (Linnell et al. 2001, Kissui e Packer 2004, Woodroffe et al. 2005b), que podem gerar conflitos com o ser humano ao atacar criações ou cultivos agrícolas levando a perdas econômicas consideráveis (Woodroffe et al. 2005a, Wang e MacDonald 2006, Kissui 2008, Dickman et al. 2011).
Nos últimos anos, os conflitos com a fauna silvestre têm aumentado em ritmo acelerado e hoje são considerados uma das maiores ameaças à conservação da vida silvestre globalmente (Marshall et al. 2007, Redpath et al. 2013), pois podem induzir o ser humano a comportamentos que ameaçam a fauna, como a retaliação, isto é, a morte ou perseguição destes animais (Treves et al. 2006, Dickman et al. 2011). Neste sentido, diversos pesquisadores têm se mobilizado para desenvolver estratégias de mitigação para estes conflitos (Bulte 2005, Woodroffe et al. 2007, Treves et al. 2009, McManus et al. 2014, Miller 2015) e entender como a coexistência entre seres humanos e animais silvestres poderia ser possível em sistemas socioecológicos, levando em consideração não apenas aspectos ambientais, mas também econômicos, políticos e socioculturais (Dickman 2010, Redpath et al. 2013, Morzillo et al. 2014, Dorresteijn et al. 2016).
Em meu projeto de pesquisa, pretendo investigar como o contexto ambiental, associado ao contato com a floresta e ao conhecimento sobre a fauna, influenciam a atitude e a intenção do ser humano em retaliar espécies de mamíferos que causam danos econômicos em paisagens de Mata Atlântica. Entender essa relação pode ser uma importante ferramenta para estratégias de mitigação de conflitos e promoção da coexistência entre animais e seres humanos. Contudo, ao aprender sobre os mecanismos que promovem a coexistência em comunidades ecológicas (Tilman 1982, Chesson 2000b), entendi que o conceito de coexistência no âmbito dos conflitos tem um significado diferente da coexistência entre espécies competidoras apresentada inicialmente. Por isso, procurei entender se, através de mecanismos abordados nas teorias da coexistência, animais e seres humanos poderiam estar, de fato, coexistindo, dada a competição por recursos limitantes entre eles (Knight 2000, Conover 2002, Woodroffe et al. 2005b).
A espécie humana pode ser considerada uma grande força ecológica (Palumbi 2001) graças a tecnologias que lhe permitiram aumentar seu fitness de forma extraordinária, o que pode ser visto no aumento exponencial de sua população, levando a maiores taxas de reprodução (Kremmer 1993; Cohen 1995, 2003), maiores taxas de sobrevivência (Oeppen e Vaupel 2002), maior tolerância a patógenos e doenças (Finch e Crimmins 2004) e numa maior habilidade no uso de recursos ao longo do espaço e do tempo devido ao desenvolvimento de técnicas de agricultura e de caça (Holdren e Erhlich 1974). O ser humano também pode ser considerado um predador de topo (Woodroffe et al. 2005b Kissui 2008) e um excelente dispersor, pois já invadiu todos os continentes do globo e seus mais variados biomas, auxiliado, a partir de uma determinada época, por tecnologias motoras lhe permitem viajar grandes distâncias em curtos períodos de tempo (Peters 2006), aumentando ainda mais sua capacidade de dispersão. Tais características fazem com que a espécie humana seja muito eficiente na utilização de recursos (R* muito baixo e uma grande diferença de fitness comparando-se às espécies), além de não mais estar sob o efeito das limitações impostas pela capacidade de suporte K (Cohen 2003), um parâmetro fundamental para os modelos de dinâmica populacional de outros organismos. Dessa forma, a espécie humana supera mecanismos de coexistência importantes, pois a força da competição interespecífica em relação à competição intraespecífica é muito maior, o que faz com que ela, competitivamente, leve as demais espécies à exclusão, não sendo possível uma coexistência estável.
Assim, baseado nas definições de Dybzinski e Tilman (2009), fui levado à conclusão de que, à luz da teoria da coexistência, seres humanos e animais silvestres não estão coexistindo, mas sim co-ocorrendo: apesar de as espécies estarem juntas no espaço e no tempo, é possível que a espécie humana esteja levando as demais espécies à exclusão em uma escala temporal maior do que podemos observar. Por isso, dada a importância que os animais têm para o próprio ser humano em suas dimensões sociais, culturais e econômicas (Conover 2002), bem como sua importância para a manutenção de funções e serviços ecossistêmicos (Pascual et al. 2010, Cardinale et al. 2012), entender quais são os mecanismos que podem promover não apenas a co-ocorrência, mas a real coexistência estável entre animais e seres humanos em sistemas socioecológicos torna-se um desafio ainda maior.
Agradecimentos: Gostaria de agradecer a Luanne Caires e a Rodolfo Liporoni pelas preciosas críticas e sugestões durante a revisão deste ensaio.
Referências bibliográficas
Amarasekare, P. 2003. Competitive coexistence is spatially structured environments: a synthesis. Ecology Letters 6, 1109-1122.
Amarasekare, P. 2009. Competition and coexistence in animal communities. In: Levin, S. A. (Ed). The Princeton Guide to Ecology. Princeton University Press, Princeton. p.196-201.
Bulte, E. H. 2005. Why compensating wildlife damages may be bad for conservation. Journal of Wildlife Management 69, 14-19.
Cardinale, B. J., Duffy, J. E., Gonzalez, A., Hooper, D. U., Perrings, C., Venail, P., Narwani, A., Mace, G. M., Tilman, D., Wardle, D. A., Kinzig, A. P., Daily, G. C., Loreau, M., Grace, J. B., Larigauderie, A., Srivastava, D. S., Naeem, S. 2012. Biodiversity loss and its impact on humanity. Nature 486, 59-67.
Chapin III, F. S., Zavaleta, E. S., Eviner, V. T., Naylor, R. L., Vitousek, P. M., Reynolds, H. L., Hooper, D. U., Lavorel, S., Sala, O. E., Hobbie, S. E., Mack, M. C. Díaz, S. 2000. Consequences of changing biodiversity. Nature 405, 234-242.
Chase, J. M., Leibold, M. A. 2003. Ecological niches: linking classical and contemporary approaches. University of Chicago Press, Chicago.
Chesson, P. 2000a. General theory of competitive coexistence in spatially-varying environments. Theoretical Population Biology 58, 211-237.
Chesson, P. 2000b. Mechanisms of maintenance of species diversity. Annual Review of Ecology and Systematics 31, 343-366.
Cohen, J. E. 1995. Population growth and Earth's human carrying capacity. Science 269, 341.
Cohen, J. E. 2003. Human population: the next half century. Science 302, 1172-1175.
Connell, J. H. 1961. The influence of interspecific competition and other factors on the distribution of the barnacle Chthamalus stellatus. Ecology 42, 710-723.
Conover, M. 2002. Resolving human-wildlife conflicts: the science of wildlife damage management. Lewis Publishers, Boca Raton.
Dickman, A. J. 2010. Complexities of conflict: the importance of considering social factors for effectively resolving human-wildlife conflict. Animal Conservation 13, 458-466.
Dickman, A. J., MacDonald, E. A., MacDonald, D. W. 2011. A review of financial instruments to pay for predator conservation and encourage human-carnivore coexistence. Proceedings of the National Academy of Sciences of the United States of America 108, 13937-13944.
Dorresteijn, I., Milcu, A.I., Leventon, J., Hanspach, J., Fischer, J. 2016. Social factors mediating human–carnivore coexistence: understanding thematic strands influencing coexistence in Central Romania. Ambio, 1-11, online.
Dybzinski, R., Tilman, D. 2009. Competition and coexistence in plant communities. In: Levin, S. A. (Ed). The Princeton Guide to Ecology. Princeton University Press, Princeton. p.186-195.
Elton, C. S., Miller, R. S. 1954. The ecological survey of animal communities: with a practical system of classifying habitats by structural characters. Journal of Ecology 42, 460-496.
Finch, C.E., Crimmins, E.M. 2004. Inflammatory exposure and historical changes in human life-spans. Science 305, 1736-1739.
Foley, J. A., DeFries, R., Asner, G. P., Barford, C., Bonan, G., Carpenter, S. R., Chapin, S. F., Coe, M. T., Daily, G. C., Gibbs, H. K., Helkowski, J. H., Holloway, T., Howard, E. A., Kucharik, C. J., Monfreda, C., Patz, J. A., Prentice, I. C., Ramankutty, N., Snyder, P. K. (2005). Global consequences of land use. Science 309, 570-574.
Gause, G. F. 1934. The struggle for existence. Williams & Wilkins, Baltimore.
Godoy, O., Kraft, N. J. B., Levine, J. M. 2014. Phylogenetic relatedness and the determinants of competitive outcomes. Ecology Letters 17, 836-844.
HilleRisLambers, J., Adler, P. B., Harpole, W. S., Levine, J. M., Mayfield, M. M. 2012. Rethinking community assembly through the lens of coexistence theory. Annual Review of Ecology, Evolution, and Systematics 43, 227-248.
Holdren, J. P., Ehrlich, P.R. 1974. Human population and the global environment: population growth, rising per capita material consumption, and disruptive technologies have made civilization a global ecological force. American Scientist 62, 282-292.
Holt, R. D., Lawton, J. H. 1994. The ecological consequences of shared natural enemies. Annual Review of Ecology and Systematics 25, 495-520.
Hubbell, S. 2001. The unified neutral theory of biodiversity and biogeography. Princeton University Press, Princeton.
Hutchinson, G. E. 1959. Homage to Santa Rosalia, or why are there so many kinds of animals? American Naturalist 93, 145–159.
Kissui, B. M. 2008. Livestock predation by lions, leopards, spotted hyenas, and their vulnerability to retaliatory killing in the Maasai steppe, Tanzania. Animal Conservation 11, 422-432.
Kissui, B. M., Packer, C. 2004. Top-down population regulation of a top predator: lions in the Ngorongoro Crater. Proceedings of the Royal Society B: Biological Sciences 271, 1867-1874.
Knight, J. 2000. Natural enemies: people-wildlife conflicts in anthropological perspective. Routledge, New York.
Kremer, M. 1993. Population growth and technological change: one million B.C. to 1990. The Quarterly Journal of Economics 108, 681-716.
Linnell, J., Swenson, J. E., Andersen, R. 2001. Predators and people: conservation of large carnivores is possible at high human densities if management policy is favourable. Animal Conservation 4, 345-349.
Loreau, M., Mouquet, N. 1999. Immigration and the maintenance of local species diversity. American Naturalist 154, 427-440.
Lubchenco, J. 1978. Plant species diversity in a marine intertidal community: importance of herbivore food preference and algal competitive abilities. American Naturalist 112, 23-39.
MacArthur, R. H., Levins, R. 1967. The limiting similarity, convergence, and divergence of coexisting species. American Naturalist 101, 377–385.
MacArthur, R. H., Wilson, E. O. 1963. An equilibrium theory of insular zoogeography. Evolution International Journal of Organic Evolution 17, 373–387.
Marshall, K., White, R., Fischer, A. 2007. Conflicts between humans over wildlife management: on the diversity of stakeholder attitudes and implications for conflict management. Biodiversity and Conservation 16, 3129-3146.
McManus, J. S., Dickman, A. J., Gaynor, D., Smuts, B. H., MacDonald, D. W. 2014. Dead or alive? Comparing costs and benefits of lethal and non-lethal human-wildlife conflict mitigation on livestock farms. Oryx 49, 1-9.
Miller, J. R. B. 2015. Mapping attack hotspots to mitigate human–carnivore conflict: approaches and applications of spatial predation risk modeling. Biodiversity and Conservation 24, 2887-2911.
Morzillo, A. T., Beurs, K. M., Martin-Mikle, C. J. 2014. A conceptual framework to evaluate human-wildlife interactions within coupled human and natural systems. Ecology and Society 19, 44-55.
Oeppen, J., Vaupel, J. W. 2002. Broken limits to life expectancy. Science 296, 1029-1031. Paine, R. T. 1966. Food web complexity and species diversity. American Naturalist 100, 65-75.
Palumbi, S. R. 2001. Humans as the world's greatest evolutionary force. Science 293, 1786-1790.
Pascual, U., Muradian, R., Brander, L., Gómez-Baggethun, E., Martín-López, B., Verma, M., Armsworth, P., Christie, M., Cornelissen, H., Eppink, F., Farley, J., Pearson, L., Perrings, C., Polasky, S., Mcneely, J., Norgaard, R., Siddiqui, R., Simpson, R. D., Turner, R. K. 2010. The economics of valuing ecosystem services and biodiversity. The Economics of Ecosystems and Biodiversity. Ecological and economic foundations. p.183-255.
Peters, P. F. 2006. Time, innovation and mobilities: travel in technological cultures, Routledge, New York.
Redpath, S. M., Young, J., Evely, A., Adams, W. M., Sutherland, W. J., Whitehouse, A., Amar, A., Lambert, R. A., Linnell, J. D. C., Watt, A., Gutiérrez, R. J. 2013. Understanding and managing conservation conflicts. Trends in Ecology and Evolution 28, 100-109.
Ricklefs, R. E. 1987. Community diversity: relative roles of local and regional processes. Science 235, 167–171.
Schoener, T. W. 2009. Ecological Niche. In: Levin, S. A. (Ed). The Princeton Guide to Ecology. Princeton University Press, Princeton. p.3-13.
Tilman, D. 1982. Resource competition and community structure. Princeton University Press, Princeton.
Treves, A., Wallace, R. B., Naughton-Treves, L., Morales, A. 2006. Co-managing human-wildlife conflicts: a review. Human Dimensions of Wildlife 11, 383-396.
Treves, A., Wallace, R. B., White, S. 2009. Participatory planning of interventions to mitigate human-wildlife conflicts. Conservation Biology 23, 1577-1587.
Wang, S. W., MacDonald, D. W. 2006. Livestock predation by carnivores in Jigme Singye Wangchuck National Park, Bhutan. Biological Conservation 129, 558-565.
Woodroffe, R., Thirgood, S., Rabinowitz, A. 2005a. People and Wildlife: conflict or co-existence? Cambridge University Press, Cambridge.
Woodroffe, R., Lindsey, P., Romanach, S., Stein, A., Ole Ranah, S. M. K. 2005b. Livestock predation by endangered African wild dogs (Lycaon pictus) in northern Kenya. Biological Conservation 124, 225-234.
Woodroffe, R., Frank, L. G., Lindsey, P. A., Ole Ranah, S. M. K., Romañach, S. 2007. Livestock husbandry as a tool for carnivore conservation in Africa's community rangelands: a case-control study. Biodiversity and Conservation 16, 1245-1260.
As abelhas noturnas e o reservatório regional de espécies
Rodolfo Liporoni
O que é um reservatório regional de espécies?
O conceito de reservatório regional de espécies (em inglês, regional species pool - RSP) pode ser definido, de uma forma ampla, como o conjunto de todas as espécies disponíveis para colonizar um dado local (Srivastava, 1999). Esse local corresponde a uma comunidade biológica na escala do tempo ecológico (Cornell & Harrison, 2014). De forma estrita, entretanto, o RSP engloba todas as espécies que podem dispersar para uma dada localidade e potencialmente persistir nela, ou seja, que passariam pelos filtros abióticos e bióticos da comunidade local (Srivastava, 1999).
Origens e aplicações do conceito
A ideia de RSP não é nova, já tendo registros na ecologia há mais de meio século (Mittelbach & Schemske, 2015). Segundo Cornell & Harrison (2014), há raízes empíricas e teóricas do conceito nas principais contribuições da Ecologia de Comunidades. Em estudos experimentais, ele aparece na hipótese do reservatório de espécies (species pool hypothesis), que foi proposta primeiramente por Taylor et al. (1990), para explicar a diversidade de comunidades vegetais (Pärtel et al., 1996). Já no campo teórico, MacArthur & Wilson (1967) trazem na teoria de biogeografia de ilhas o conceito similar de mainland pool species, enquanto Hubbell (2001), na teoria neutra, e Leibold et al. (2004), na teoria de metacomunidades, falam de regional pool (Cornell & Harrison, 2014). Contudo, apesar do seu papel essencial no arcabouço teórico das principais ideias ecológicas, o valor do RSP já foi muito criticado por alguns ecólogos que defendiam um controle forte dos processos de alcance local, como a competição, sobre as comunidades (Cornell & Harrison, 2014). Ricklefs (1987) ressalta que os ecólogos demoraram a perceber a importância da perspectiva regional e propõe que as comunidades são o resultado de um balanço entre processos locais (predação, exclusão competitiva, adaptação, variação estocástica) e regionais (especiação, dispersão).
Sendo assim, quando tentamos entender a estrutura e a dinâmica de uma comunidade local, considerar o seu RSP pode ser muito útil. Por exemplo, a diminuição da densidade de espécies em solos temperados fertilizados pode ser explicada por meio de um menor RSP de espécies adaptadas às condições desse tipo de habitat mais especializado, ao invés de se evocar efeitos competitivos fortalecidos (Taylor et al., 1990). Assim, o RSP pode servir como explicação alternativa para gradientes de diversidade em relação à produtividade (Cornell & Harrison, 2014). Por outro lado, quando já se sabe que a comunidade não é estruturada pelas interações locais, como ocorre em habitats frequentemente perturbados ou com muitas espécies raras ou transitórias, os efeitos do RSP sobre a sua montagem são especialmente importantes e impossíveis de ignorar (Cornell & Harrison, 2014).
Com isso, inúmeras aplicações do RSP foram visualizadas pelos ecólogos. Por exemplo, podemos verificar se a composição local observada é congruente com o que seria esperado, baseando-se em modelos nulos, levando-se em conta o seu RSP (Mittelbach & Schemske, 2015). O conceito também pode ser usado para testar a abertura das comunidades a processos regionais, comparando-se a riqueza local com a riqueza regional para determinar se as comunidades estão saturadas (Cornell & Harrison, 2014; e.g. Tilman, 1997). No que tange a montagem das comunidades, e numa escala mais local, o RSP pode ser usado para avaliar a força dos filtros ambientais e das interações, além de ser aplicado em problemas de restauração para a escolha de espécies (Mittelbach & Schemske, 2015). Por fim, pesquisas recentes usam o RSP para testar diferentes influências regionais sobre a beta-diversidade, a estrutura filogenética e os resultados de experimentos (Cornell & Harrison, 2014). Portanto, o RSP tem sido útil para analisar os efeitos de escalas maiores sobre as comunidades, preenchendo lacunas entre as escalas locais e regionais (Cornell & Harrison, 2014).
Reservatórios regionais e modos de nidificação de abelhas noturnas
As abelhas geralmente são vistas como criaturas do sol, voando em dias iluminados, calmos e coloridos (Michener, 2007). Contudo, algumas abelhas ocuparam o nicho noturno, visitando as flores no intervalo entre os crepúsculos vespertino e matutino (Warrant, 2007). O forrageamento noturno apareceu cerca de 19 vezes ao longo da filogenia das abelhas, o que torna a explicação dessa novidade evolutiva bastante complexa (Wcislo & Tierney, 2009). No âmbito da minha pesquisa com comunidades de abelhas noturnas da Mata Atlântica, pretendo entender a biologia básica desse grupo e seus padrões de distribuição, composição, riqueza e abundância. As características do RSP tem o potencial de explicar muitos desses padrões, o que não estava evidente para mim antes de cursar a disciplina. Um exemplo desse potencial envolve a riqueza de abelhas noturnas da família Halictidae, tribo Augochlorini, encontradas na minha área de estudo.
Essa tribo apresenta distribuição neotropical, com cerca de 525 espécies em 41 gêneros, dos quais apenas 3 apresentam hábito noturno (Engel, 2000). Das quase 40 espécies noturnas desses gêneros, mais de 30 pertencem a Megalopta, que apresentou grande diversificação recente, enquanto os outros dois gêneros, Megommation e Megaloptidia, ficaram restritos a menos de 10 espécies; Megalopta nidifica em troncos de árvores, que são muito comuns em florestas tropicais, mas os outros gêneros compartilham a plesiomorfia de nidificar no solo (Tierney et al., 2012). Na nossa região, há apenas um único registro de espécie noturna de Augochlorini que nidifica no solo (Cordeiro, 2015). Uma das minhas hipóteses iniciais, então, buscava explicar essa presença limitada de espécies noturnas que nidificam no solo por meio das características das espécies (fisiologia, morfologia, comportamento, etc.) e do ambiente (pluviosidade, umidade, etc.), além de considerar a menor diversificação do grupo que nidifica no solo como um todo.
Contudo, a disciplina me fez refletir sobre uma possível explicação alternativa, que é considerar o RSP. Então, decidi pesquisar sobre quais seriam os possíveis RSP para espécies de Augochlorini que nidificam ou no solo ou em troncos nas Américas e encontrei um padrão interessante. As espécies nidificadoras de solo são encontradas na bacia Amazônica ou no sul do Brasil e norte da Argentina, enquanto que as espécies nidificadoras de troncos de árvores se distribuem por toda a região neotropical (Tierney et al., 2012). Isso me fez considerar que a baixa riqueza e a raridade de abelhas Augochlorini nidificadoras de solo na nossa região, especialmente áreas da Mata Atlântica paulista onde trabalho, pode ser um reflexo de um RSP pequeno para esse tipo de espécie, ao invés de depender apenas de características ambientais e biológicas das espécies em questão, que era a minha ideia inicial. Se minha área de estudo estivesse mais ao sul ou mais ao norte, sob influência de outro RSP, tal riqueza poderia ser diferente, pela proximidade com a área de maior ocorrência das espécies noturnas que nidificam no solo. Portanto, o conceito de RSP se mostrou potencialmente poderoso para explicar parte dos padrões que observo em campo e pretendo desenvolver as ideias aqui apresentadas e incluir esse conceito com mais frequência no meu programa de pesquisa futuro.
Agradecimentos: Luanne Caires e Lucas Teixeira, pelos valiosos comentários e críticas durante a revisão deste ensaio.
Referências bibliográficas
Cordeiro, G.D. 2015. Fenologia reprodutiva, polinização e voláteis florais do cambuci (Campomanesia phaea (O.Berg) Landrum 1984 - Myrtaceae. Tese de Doutorado. Universidade de São Paulo.
Cornell, H.V. & Harrison, S.P. 2014. What are species pools and when are they important? Annual Review of Ecology, Evolution, and Systematics, 45: 45-67.
Engel, M.S. 2000. Classification of the bee tribe Augochlorini (Hymenoptera: Halictidae). Bulletin of the American Museum of Natural History, 250: 1-90.
Hubbell, S.P. 2001. The Unified Neutral Theory of Biodiversity and Biogeography. Princeton University Press, Princenton, NJ
Leibold, M.A., Holyoak, M., Mouquet, N., Amarasekare, P., Chase, J.M., et al. 2004. The metacommunity concept: a framework for multi-scale community ecology. Ecology Letters, 7: 601-613.
MacArthur, R.H. & Wilson, E.O. 1967. The Theory of Island Biogeography. Princeton University Press, Princeton, NJ.
Michener, C.D. 2007. The Bees of the World. Johns Hopkins University Press, Baltimore.
Mittelbach, G.G. & Schemske, D.W. 2015. Ecological and evolutionary perspectives on community assembly. Trends in Ecology & Evolution, 30(5): 241-247.
Pärtel, M., Zobel, M., Zobel, K. & van der Maarel, E. 1996. The species pool and its relation to species richness evidence from Estonian plant communities. Oikos, 75: 111-117.
Ricklefs, R.E. 1987. Community diversity: the relative roles of regional and local processes. Science, 235: 167-171.
Srivastava, D.S. 1999. Using local-regional richness plots to test for species saturation: pitfalls and potentials. Journal of Animal Ecology, 68: 1-16.
Taylor, D.R., Aarssen, L.W. & Loehle, C. 1990. On the relationship between r/K selection and environmental carrying capacity: a new habitat templet for plant life history strategies. Oikos, 58: 239–250.
Tierney, S.M., Sanjur, O., Grajales, G.G., Santos, L.M., Bermingham, E. & Wcislo, W.T. 2012. Photic niche invasions: phylogenetic history of the dim-light foraging augochlorine bees (Halictidae). Proceedings of the Royal Society B: Biological Sciences, 279: 794-803.
Tilman, D. 1997. Communitu invasibility, recruitment limitation, and grassland biodiversity. Ecology, 78(1): 81-92.
Warrant, E. 2007. Nocturnal bees. Current Biology, 17 (23): 991-992.
Wcislo, W.T. & Tierney, S.M. 2009. Behavioural environments and niche construction: The evolution of dim-light foraging in bees. Biological Reviews, 84(1): 19-37.
Estruturação de comunidades: diferentes escalas e relações com a facilitação
Luanne Caires
Uma comunidade ecológica é uma assembleia de populações de espécies que ocorrem juntas no espaço e no tempo. A estruturação de cada assembleia abrange padrões de riqueza, composição e abundância das espécies, sendo que esses padrões decorrem de processos atuantes em diferentes escalas espaciais e temporais (Begon 2007). Em escalas locais e janelas temporais curtas, geralmente são estudados os processos de interações de espécies entre si e com o ambiente local; já em escalas espaciais e temporais maiores, ganham destaque os processos históricos e biogeográficos, como história evolutiva das espécies, taxas de especiação, dispersão entre áreas, dentre outros (Sobral & Cianciaruso 2012).
As perguntas fundamentais em Ecologia de Comunidades giram em torno de compreender os padrões de riqueza, composição e abundância das espécies e seus processos associados. Assim, a busca pelo entendimento da estruturação das comunidades é extremamente relevante para o desenvolvimento não apenas da teoria ecológica, mas também da sua prática de pesquisa. O debate sobre a estruturação das comunidades é antigo, remontando pelo menos a Clements e Gleason no início do século passado. De acordo com Clements (1916), as comunidades seriam um superorganismo, estruturadas essencialmente por fortes interações entre as espécies, unidas tanto no presente quanto durante suas histórias evolutivas compartilhadas. Gleason (1926), por outro lado, via a estruturação da comunidade dirigida principalmente pelas exigências e tolerâncias ambientais das espécies, com um grande componente estocástico e histórico na determinação de sua composição.
Com o florescimento da teoria clássica de nicho a partir dos trabalhos de Hutchinson e MacArthur nas décadas de 1950 e 1960 (embora a ideia de nicho tenha raízes anteriores; ver Grinnell 1917, Elton 1927 e revisão de Chase & Liebold 2003), iniciou-se um período com grande ênfase na estruturação determinística das comunidades, resultante das interações locais entre as espécies e seu ambiente. Esse conjunto de aspectos ecológicos determinísticos foi agrupado por Vellend (2010) como seleção. Com base nessas ideias, esforços de pesquisa comuns nas décadas de 1960 a 1980 eram voltados para a exploração de padrões de largura e sobreposição de nicho, analisados principalmente sob a luz da teoria de competição (Greene 2005). Vários conceitos relevantes foram desenvolvidos e intensamente testados nesse período, como, por exemplo, o conceito de diferenciação de nicho (Hutchinson 1959) e o de similaridade limitante (MacArthur e Levins 1967), assim como as regras de montagem de comunidade (“assembly rules”) propostas por Diamond (1975).
Essa separação na teoria ecológica entre a organização das comunidades e os processos que ocorrem em escalas espaciais e temporais maiores foi denominada “eclipse da história” (Ricklefs 1987). Vale destacar que, durante esse período de eclipse, MacArthur e Wilson (1963) desenvolveram a teoria de biogeografia de ilhas, que incorpora processos históricos e geográficos, como imigração e distribuição das ilhas em relação a uma fonte continental. Mas foi só a partir da década de 1980 que os processos históricos e biogeográficos voltaram a ser mais presentes na consideração sobre a estruturação de comunidades. Entre os primeiros estudos a reconhecer a importância de processos que ocorrem em escalas espaciais e temporais maiores (geralmente denominados processos regionais) e a incentivar sua (re)inclusão na teoria de estruturação de comunidades encontram-se os trabalhos de Cornell (1985), Ricklefs (1987) e Ricklefs & Schluter (1993).
Atualmente, as tentativas de unificação dos processos locais e regionais na montagem e manutenção de comunidades são várias e amplamente aceitas (Chase 2003, Lortie et al. 2004, Vellend 2010), adicionando a influência de processos neutros trabalhados principalmente na teoria de biogeografia de ilhas (MacArthur e Wilson 1963) e na teoria neutra (Hubbell 1979, 2001). Processos biogeográficos e evolutivos determinam o pool regional a partir do qual se formam as comunidades locais, nas quais as abundâncias das espécies seriam moldadas principalmente por seleção e deriva, além de dispersão em escalas menores. Do mesmo modo, processos locais podem moldar eventos de dispersão e especiação e contribuir para a manutenção da diversidade global no tempo evolutivo (Valiente-Banuet et al. 2006, Vellend 2010). Desse modo, a estruturação de comunidades depende de muitos mecanismos que atuam em diferentes escalas de tempo e espaço e sua dinâmica pode oferecer um contexto sólido para o desenvolvimento de uma teoria geral de organização de comunidades (Drake 1990, Roughgarden 2009, Vellend 2010).
Ao longo da disciplina, a perspectiva de integração entre processos ocorrendo em escalas espaciais e temporais maiores e menores e seu impacto na estruturação de comunidades foi de grande importância para a ampliação da forma como encaro meu tema de pesquisa: a facilitação entre espécies vegetais. A facilitação pode ser definida como uma interação positiva e não trófica entre espécies, mediada por mudanças nas condições abióticas (microclima ou condições do solo, por exemplo) e nas interações indiretas com outros organismos, como atração de polinizadores e dispersores ou proteção contra herbivoria (Brooker et al. 2008, Bonanomi et al. 2011).
Esta interação pode influenciar a estruturação de comunidades pela ampliação da distribuição de espécies em uma escala espacial local e regional (Callaway 2007). Relacionado a esse aspecto está a ideia de ampliação do nicho realizado de uma espécie quando a espécie facilitadora fornece condições de estabelecimento em locais antes desfavoráveis para a espécie facilitada (Bruno et al. 2003, Rodriguez-Cabal et al. 2012). Essa expansão do nicho realizado pode aumentar a diversidade nas comunidades, mas também pode diminuí-la caso a espécie facilitada leve à exclusão de outras por competição, predação e outros processos. Em ambos os casos, há consequências sobre as diversidades alfa e beta (Stachowicz 2001, Young et al. 2005). Em termos de escala temporal, a facilitação pode possibilitar a persistência de uma espécie na comunidade fornecendo nichos de regeneração no tempo ecológico e no tempo evolutivo, como possivelmente é o caso da persistência de espécies vegetais do Terciário graças à facilitação por espécies que emergiram no Quaternário após a drástica mudança climática entre esses dois períodos (Valiente-Banuet et al. 2006).
A facilitação também pode influenciar a estruturação de comunidades afetando a sucessão ecológica, uma vez que espécies iniciais (pioneiras) podem modificar o ambiente, a disponibilidade de recursos e oferecer microssítios favoráveis ao estabelecimento e desenvolvimento de espécies tardias (Clements 1936, Connell & Slatyer 1977, Pickett et al. 1987). Esse processo tem ganhado relevância em técnicas recentes de restauração que visam facilitar a sucessão ecológica em áreas degradadas (Suding et al. 2004, Padilla & Pugnaire 2006, Gómez-Aparicio 2009). Durante meu mestrado pretendo investigar mecanismos pelos quais espécies pioneiras podem facilitar o desempenho de espécies não pioneiras em uma área de restinga restaurada. Assim, meu trabalho se insere no contexto de sucessão assistida, mas restrito a uma escala espacial local e à fase inicial desse processo.
As espécies, contudo, podem responder diferentemente às potenciais espécies facilitadoras. Nesse sentido, a relação entre facilitação e processos históricos evolutivos (escala mais ampla) me apresentou uma nova forma de analisar as respostas das espécies na escala local. De modo geral, há indícios de que espécies filogeneticamente distantes (Valiente-Banuet & Verdú 2007) ou funcionalmente distintas (Callaway 2007) têm maiores chances de estar envolvidas em relações de facilitação. Isso porque espécies filogeneticamente próximas teriam alta similaridade funcional e de nicho caso os atributos sejam filogeneticamente conservados. Logo, a competição entre elas seria mais intensa, sobrecompensando efeitos facilitadores (Prinzing et al. 2001, Webb et al. 2002, Wiens & Graham 2005, Johnson & Stinchcombe 2007, Castillo et al. 2010). Na minha área de estudo, análises preliminares indicam que algumas espécies não pioneiras têm respondido positivamente aos efeitos das espécies pioneiras, enquanto outras não (Martini, comunicação pessoal). Nesse caso, uma análise que relacione as respostas de cada espécie a possíveis efeitos da proximidade filogenética e similaridade de atributos funcionais pode contribuir para a elucidação dessas diferenças de desempenho espécie-específicas e para a minha compreensão dos feedbacks entre escalas espaciais e temporais distintas na estruturação das comunidades.
Agradecimentos: Agradeço a Rodolfo Liporoni e Lucas Teixeira pelas proveitosas e divertidas discussões ecológicas durante a elaboração deste ensaio e pela paciência em revisá-lo.
Referências bibliográficas
Begon, M., Townsend, C.R. & Harper, J.L. 2007. Ecologia: de indivíduos a comunidades. Porto Alegre: Artmed.
Bonanomi, G.; Incerti, G. & Mazzoleni, S. 2011. Assessing occurrence, specificity and mechanisms of plant facilitation in terrestrial ecosystems. Plant Ecology 212: 1777-1790.
Brooker, R.W.; Maestre, F.T.; Callaway, R.M.; Lortie, C.L.; Cavieres, L.A.; Kunstler, G.; Liancourt, P.; Tielbörger, K.; Travis, J.M.J.; Anthelme, F.; Armas, C.; Coll, L.; Corcket, E.; Delzon, S.; Forey, E.; Kikvidze, Z.; Olofsson, J.; Pugnaire, F.; Quiroz, C.L.; Saccone, P.; Schiffers, K.; Seifan, M.; Touzard, B. & Michalet, R. 2008. Facilitation in plant communities: the past, the presente and the future. Journal of Ecology 96: 18-34.
Bruno, J.F., Stachowicz, J.J. & Bertness, M.D. 2003. Inclusion of facilitation into ecological theory. Trends in Ecology and Evolution 18(3): 119-125.
Callaway, R.M. 2007. Positive interactions and interdependence in plant communities. Dordrecth, The Netherlands: Springer.
Castillo, J.P., Verdú, M. & Valiente-Banuet, A. 2010. Neighborhood phylodiversity affects plant performance. Ecology 91(12): 3656-3663.
Chase, J.M. 2003. Community assembly: when should history matter? Oecologia 136: 489-498.
Chase, J.M. & Leibold, M.A. 2003. Ecological niches: linking classical and contemporary approaches. Chicago: The University of Chicago Press.
Clements, F.E. 1916. Plant Succession: an analysis of the development of vegetation. Washington: Carnegie Institute Publication.
Clements, F.E. 1936. Nature and structure of the clímax. Journal of Ecology 24: 252-284.
Connell, J.H. & Slatyer, R.O. 1977. Mechanisms of succession in natural communities and their role in community stability and organization. The American Naturalist 111(982): 1119-1144.
Cornell, H.V. 1985. Local and regional richness of Cynipine gall wasps on California oaks. Ecology 66: 1247-1260.
Diamond, J. M. 1975. Assembly of species communities. In: Cody, M.L. & Diamond, J.M. (Eds). Ecology and evolution of communities. Cambridge: Harvard University Press.
Drake, J.A. 1990. The mechanics of community assembly and succession. Journal of Theoretical Biology 147: 213-233.
Elton, C. 1927. Animal Ecology. Londres: Sidgwick & Jackson.
Gleason, H.A. 1926. The individualistic concept of the plant association. Bulletin of the Torrey Botanical Club 53: 7-26.
Gómez-Aparicio, L. 2009. The role of plant interactions in the restoration of degraded ecosystems: a meta-analysis across life-forms and ecosystems. Journal of Ecology 97: 1202-1214.
Greene, H.W. 2005. Historical influences on community ecology. Proceedings of the National Academy of Sciences 102(24): 8395-8396.
Grinnell, J. 1917. The niche-relationships of the California thrasher. The Auk 34(4): 427-433.
Hubbell, S.P. 1979. Tree dispersion, abundance and diversity in a tropical dry forest. Science 203(4387): 1299-1309.
Hubbell, S.P. 2001. The unified neutral theory of biodiversity and biogeography. New Jersey: Princeton University Press.
Hutchinson, G.E. 1959. Homage to Santa Rosalia or Why are there so many kinds of animals? The American Naturalist 93(870): 145-159.
Johnson, M.T.J. & Stinchcombe, J.R. 2007. Na emerging synthesis between community ecology and evoluitonary biology. Trends in Ecology and Evolution 22(5): 251-257.
Lortie, C.J., Brooker, R.W., Choler, P., Kikvidze, Z., Michalet, R., Pugnaire, F.I. & Callaway, R.M. 2004. Rethinking plant community theory. Oikos 107(2): 433-438.
MacArthur, R.H. & Wilson, E.O. 1963. An equilibrium theory of insular zoogeography. Evolution 17: 373–387.
MacArhur, R.H. & Levins, R. 1967. The limiting similarity, convergence and divergence of coexisting species. The American Naturalist 101(921): 377-385.
Padilla, F.M. & Pugnaire, F.I. 2006. The role of nurse plants in the restoration of degraded environments. Frontiers in Ecology and the Environments 4(4): 196-202.
Pickett, S.T.A., Collins, S.L. & Armesto, J.J. 1987. Models, mechanisms and pathway of succession. The Botanical Review 53(3): 336-371.
Prinzing, A., Durka, W., Klotz, S. & Brandl, R. 2001. The niche of higher plants: evidence for phylogenetic conservatism. Proceedings of the Royal Society B 268:2383–2389.
Ricklefs, R.E. 1987. Community diversity: Relative roles of local and regional processes. Science 235(4785): 167-171.
Ricklefs, R.E. & Schluter, D. 1993. Species diversity in ecological communities: historical and geographical perspectives. Chicago: University of Chicago Press.
Rodriguez-Cabal, M.A., Barrios-Garcia, M.N. & Nuñez, M.A. 2012. Positive interactions in ecology: filling the fundamental niche. Ideas in Ecology and Evolution 5: 36-41.
Roughgarden J. 2009. Is there a general theory of community ecology? Biology and Philosophy 224:521–529.
Sobral, F.L. & Cianciaruso, M.V. 2012. Estrutura filogenética e funcional de assembleias: (re)montando a Ecologia de Comunidades em diferentes escalas espaciais. BioScience Journal 28(4): 617-631.
Stachowicz, J.J. 2001. Mutualism, facilitation and the structure of ecological communities. BioScience 51(3): 235-246.
Suding, K.N., Gross, K.L. & Houseman, G.R. 2004. Alternative states and positive feedbacks in restoration ecology. Trends in Ecology and Evolution 19(1): 46-53.
Valiente-Banuet, A., Rumebe, A.V., Verdú, M. & Callaway, R.M. 2006. Modern Quaternary plant lineages promote diversity through facilitation of ancient Tertiary lineages. Proceedings of the National Academy of Sciences 103(45): 16812-16817.
Valiente-Banuet, A. & Verdu, M. 2007. Facilitation can increase the phylogenetic diversity of plant communities. Ecology Letters10: 1029–1036.
Vellend, M. 2010. Conceptual synthesis in Community Ecology. The Quarterly Review of Biology 85(2): 183-206.
Webb, C.O., Ackerly, D.D., McPeek, M.A. & Donoghue, M.J. 2002. Phylogenies and community ecology. Annual Review of Ecology, Evolution and Systematics 33: 475-505.
Wiens, J.J. & Graham, C.H. 2005. Niche conservatism: integrating evolution, ecology, and conservation biology. Annual Review of Ecology, Evolution, and Systematics 36: 519–539.
Young, T.P., Petersen, D.A. & Clary, J.J. 2005. The ecology of restoration: historical links, emerging issues and unexplored realms. Ecology Letters 8: 662-673.
Teoria geral, teoria constituinte e modelos: como conciliar Teoria Neutra e Teoria de Nicho?
Danilo Pereira Mori
A história da ecologia de comunidades é marcada pelo estudo de padrões de diversidade, abundância e composição das espécies (Roughgarden 2009, Vellend 2010). Isso levou à ênfase na busca pelos processos que são mais importantes nos sistemas de estudos (Vellend 2010). A ecologia de comunidades tornou-se um atlas de corpos teóricos que pouco conversavam entre si, descrevendo diferentes narrativas para diferentes sistemas biológicos ( e.g. lagos, ilhas, florestas) (Roughgarden 2009). Nesse contexto, há a necessidade de sintetizar a ecologia de comunidades em uma teoria unificada em que todas as comunidades compartilhem versões de uma mesma narrativa (para uma discussão Roughgarden 2009; Scheiner & Willig, 2008). Uma proposta é desenvolver uma teoria formacional, focada não na diversidade dentro da comunidade, mas na diversidade de comunidades (Roughgarden, 2009). Dentro desse paradigma, podemos entender as comunidades como o resultado da interação, em diferentes escalas espaciais e temporais, de quatro processos: deriva, seleção, dispersão e especiação (Vellend, 2010). A dinâmica da comunidade local (mudanças ao longo do tempo na abundância relativa de espécies em uma determinada área) é governada pela adição de novas espécies por dispersão (movimento de indivíduos no espaço) e especiação (surgimento de uma nova espécie), os indivíduos introduzidos na comunidade têm suas abundâncias moldadas por deriva e seleção (Vellend, 2010). As dinâmicas internas de deriva e seleção, moldam os processos de especiação e de dispersão das espécies residentes para fora da comunidade local (Vellend, 2010). Assim, essa proposta de teoria formacional não é apenas uma teoria de diversidade de comunidades, mas, ao envolver especiação e dispersão para fora da comunidade local, ela também é uma teoria de formação de novas espécies, ligando o conhecimento ecológico com o evolutivo.
O propósito de uma teoria é fornecer um conjunto de ligações para observações e modelos de nível inferior ou teorias dessas observações (Scheiner & Willig, 2008). Podemos reconhecer três níveis de teoria: i) teoria geral, um grande domínio da ciência e um conjunto de princípios fundamentais; ii) teoria constituinte, que estabelece limites e identifica parâmetros de interesse particular, orientando o desenvolvimento de modelos; iii) modelos, instâncias de uma teoria constituinte, onde reside a formulação de predições e entendimento causal (Scheiner & Willig, 2008). A construção de modelos mecanísticos é uma abordagem robusta na análise de padrões de comunidades (Werner 1998). Para a construção de um modelo mecanístico é necessário explicitar em algum nível a interação entre os elementos que estão em um nível inferior de organização do fenômeno a ser estudado. Por vezes, não é clara a distinção entre os 3 níveis de teoria (Scheiner & Willig, 2011); eu vejo a proposta de Vellend (2010) tanto como teoria geral quanto teoria constituinte, pois ela propõe um conjunto de princípios fundamentais e pode ser uma base para elaboração de modelos. De qualquer maneira, um passo obvio é a construção de modelos mecanísticos que explicite a relação entre os quatro processos (para uma discussão veja Scheiner & Willig, 2011). Um obstáculo na construção de tais modelos é a atual falta de consenso na conciliação de deriva e seleção. Esse problema emerge do já datado debate entre teoria de nicho (TNI) e teoria neutra (TNE) (Clark 2009, Chase and Myers 2011, Gravel et al. 2011, Rosindell et al. 2012). Ambas teorias são sobre as mudanças da abundância relativa das espécies, contudo, elas têm previsões opostas: enquanto TNE advoga que as dinâmicas da comunidade são regidas por deriva ecológica, ou seja, as abundâncias relativas das espécies mudam aleatoriamente; TNI advoga que as dinâmicas biológicas são resultado das diferenças determinísticas de fitness¹ entre as espécies, ou seja, seleção (Vellend 2010). O debate entre as duas teorias envolve diversos pontos (veja, Gravel et al. 2011, Wennekes et al. 2012 e Vellend et al. 2014) mas ao meu ver o principal ponto de discordância é nos pressupostos. TNE (Hubbell 2001) pressupõem a equivalência funcional das espécies, ou seja, todos os indivíduos em um mesmo nível trófico apresentam iguais taxas demográficas; assim, a comunidade é estruturada por eventos aleatórios de nascimento, morte, dispersão e especiação. TNI é um conjunto de diversas teorias que compartilham um mesmo pressuposto: as espécies diferem em suas taxas demográficas, devido as diferentes histórias evolutivas que as permitiram acumular certos atributos que conferem vantagem ou desvantagem nas diversas interações abióticas e bióticas (Chase & Leibold 2003). A dificuldade em criar modelos mecanísticos integrando os dois processos reside, em parte, nessa dicotomia entre os pressupostos. A seguir apresento algumas propostas de conciliação entre TNI e TNE, faço uma breve comparação e concluo falando como a disciplina me auxiliou a desenvolver uma visão mais crítica dessas propostas e quanto ainda tenho que refletir sobre a questão.
A proposta do contínuo, propõe que as comunidades biológicas residem em um contínuo de importância relativa dos processos descritos pela TNE e pela TNI, sendo que nos extremos residem aquelas comunidades descritas unicamente ou por uma ou pela outra teoria (Gravel et al. 2006, Adler et al. 2007). Gravel et al. (2006) partem da dinâmica básica de nascimentos, mortes, dispersão e especiação da TNE onde todos os indivíduos tem igual probabilidade em qualquer um desses eventos e introduz a ideia de nicho ao estabelecer que cada espécie possui uma probabilidade diferenciada de nascimento dependendo do gradiente de habitat. No trabalho de Gravel et al. (2006) variava-se os valores de imigração nas simulações e inferia-se a posição da comunidade no continuo ao analisar o quanto a dinâmica resultante se afastava da dinâmica esperado segundo o mesmo modelo sem a diferenciação de nicho. Já Adler et al. 2007, partem da teoria moderna de coexistência (Chesson 2000) e constroem um arcabouço teórico onde a mudança na intensidade de mecanismos estabilizadores (aqueles que aumenta a competição intra específica com relação a competição entre espécies) e equalizadores (aqueles que diminuem a diferença na capacidade competitiva das espécies) dita a posição da comunidade no contínuo neutro-nicho. Adler et al. (2007), consideram que comunidades neutras são aquelas onde não há mecanismos estabilizadores e as espécies tem as mesmas capacidades competitivas, as comunidades que se afastam dessa configuração se afastam do extremo neutro do contínuo.
Dentro da proposta de grupos emergentes, grupo emergente é um conjunto de espécies que são similares o suficiente para se comportarem de maneira neutra (Scheffer and van Nes 2006, Hérault 2007). Grupos emergentes são definidos como grupos de espécies que compartilham combinações similares de atributos que refletem soluções ajustadas entre respostas adaptativas e constrições evolutivas (Lavorel et al. 1997). Essa proposta assume neutralidade, ou seja, equivalência funcional entre as espécies de um mesmo grupo emergente, e diferença de fitness entre as espécies de grupos emergentes distintos.
A última proposta que apresento aqui é a de que comunidades são sistemas que apresentam transição de fase entre a fase neutra e a fase de nicho (Fisher et al. 2014). Transição de fase é quando um sistema muda abruptamente em seu comportamento qualitativo, quando uma característica do ambiente é modificada. Um bom exemplo de sistema de transição de fase é a da mudança de estado da água do sólido, liquido e gasoso que depende da temperatura e pressão. A transição de fase entre nicho e neutro depende do tamanho da comunidade (número de indivíduos total) e da heterogeneidade ambiental: grandes comunidades com pouca heterogeneidade estão na fase nicho, enquanto, que comunidades pequenas com grande heterogeneidade estão na fase neutra. Na fase neutra, mesmo as espécies apresentando diferenças nas suas capacidades competitivas, essas diferenças não se manifestavam. Na fase de nicho, as espécies mais abundantes eram aquelas com maior capacidade competitiva.
Podemos dividir as propostas de conciliação em dois tipos: a) aquelas em que a dinâmica neutra pode emergir como resultado da história evolutiva das espécies do sistema, e em último grau de uma assinatura particular de nicho; b) e aquelas onde a diferenciação de nicho, as forças seletivas, não conseguem subjugar os processos estocasticas. No tipo (a) contempla-se a proposta de Contínuo de Adler et al. 2007 e de grupos emergentes. A proposta de Adler et al. (2007) está nessa categoria pois, dentro da teoria de coexistência moderna, tanto os mecanismos estabilizadores quanto equalizadores emergem de trade-offs (Chesson 2000) e esses, por sua vez, são oriundos da história evolutiva das espécies. No tipo (b) estão a proposta de contínuo de Gravel el al. (2006) e de transição de fase, onde espécies com diferenciação de nicho comportam-se como espécies neutras em certas condições ( e.g. isolamento, heterogeneidade ambiental).
Sempre vi a dinâmica das comunidades ecológicas como uma combinação de eventos probabilísticos, ao nível dos indivíduos, de morte, nascimento, dispersão e especiação. Provavelmente, por conta da primeira teoria ecológica que me debrucei durante minha formação, a TNE (Hubbell 2001). A proposta do continuo era uma ideia que se encaixava perfeitamente nessa visão, pois cada um desses eventos probabilísticos era decidido pelo lançamento de um dado com tantas faces quantos indivíduos no sistema: em um extremo um dado honesto, o extremo neutro, em outro um dado totalmente viciado, onde cada face possuía uma probabilidade de sucesso, o extremo nicho. Notem que dentro dessa metáfora eu coloco os eventos ao nível de indivíduo, então, as variações intraespecíficas podem ser consideradas. Logo, a ideia de que as comunidades reais residem em um continuo de importância relativa de processos neutros e de nicho estava bem aceita em minha mente e segui meu mestrado me questionando quais fatores poderiam modular a posição das comunidades nesse contínuo. Foi na aula de Biogeografia de Ilhas, onde discutimos o artigo de Alonso et al. (2015), que comecei a me questionar sobre as diferentes formas de conciliar neutro e nicho. A abordagem apresentada no artigo é similar às abordagens de grupos emergentes. Nesse momento me dei conta que precisava rever a validade da proposta que tomo como pressuposto em meu mestrado. Ainda não estou certo da generalidade e validade da proposta do contínuo neutro nicho, mas acredito que é possível colocar a proposta de grupos emergentes dentro da ideia de continuo. Para grupos emergentes podemos entender a importância relativa de nicho e neutro comparando o número de grupos emergentes o número de espécies por grupo. Quanto maior o número de espécies por grupo mais próximo do extremo neutro estará a comunidade e menor o número de grupos, mais próximo do extremo neutro estará a comunidade. Eu ainda tenho que refletir mais sobre se é possível fundir a proposta de fases alternativas de Fisher et al. (2014) com a proposta de contínuo. De qualquer maneira, todas essas propostas podem ser encaixadas dentro da minha metáfora do gradiente de dados honestos e viciados, não sei se isso quer dizer que é possível construir um modelo básico que posso ter versões para cada uma das diferentes propostas. A reflexão sobre como testar as diferentes propostas e principalmente como relaciona-las ainda é uma tarefa que precisa ser melhor desenvolvida no futuro.
É interessante pensar sobre o impacto das diferentes propostas de conciliação para a teoria unificada formacional. Como argumentei, a teoria unificada é também uma teoria sobre surgimento de novas espécies e, portanto, sobre padrões microevolutiovos. As diferentes formas de se conciliar teoria neutra e teoria de nicho tem impactos nas previsões de especiação: deriva e seleção são processos que moldam não apenas as abundâncias das espécies, mas também a abundâncias das classes fenotípicas dentro de uma espécie. Pressupondo-se deriva como descrito pela teoria neutra, por exemplo, espera-se que todas os indivíduos independentemente de sua classe fenotípica tenham as mesmas taxas de natalidade e mortalidade, assim a deriva não seria apenas das espécies, mas das classes fenotípicas também. Quais os padrões de especiação esperados das diferentes propostas de reconciliação da teoria neutra e teoria de nicho? Esses padrões são observados na natureza? É possível unificar todas as propostas conciliadoras em uma proposta única? Se for possível qual o impacto disso na teoria unificada? Eu não tenho a resposta para nenhuma dessas perguntas. Mas podemos ficar contentes que a busca por uma teoria unificada já gerou frutos: mostrou as lacunas de conhecimento dentro de nosso arcabouço teórico.
Referências Bibliográficas
Adler, Peter B., Janneke HilleRisLambers, and Jonathan M. Levine. “A niche for neutrality.” Ecology letters 10.2 (2007): 95-104.
Alonso, David, et al. “Fish community reassembly after a coral mass mortality: higher trophic groups are subject to increased rates of extinction.”Ecology letters 18.5 (2015): 451-461.
Chase, Jonathan M., and Jonathan A. Myers. “Disentangling the importance of ecological niches from stochastic processes across scales.” Philosophical Transactions of the Royal Society of London B: Biological Sciences366.1576 (2011): 2351-2363.
Chase, Jonathan M., and Mathew A. Leibold. Ecological niches: linking classical and contemporary approaches. University of Chicago Press, 2003.
Chesson, Peter. “Mechanisms of maintenance of species diversity.” Annual review of Ecology and Systematics (2000): 343-366.
Clark, James S. “Beyond neutral science.” Trends in Ecology & Evolution24.1 (2009): 8-15.
Fisher, Charles K., and Pankaj Mehta. “The transition between the niche and neutral regimes in ecology.” Proceedings of the National Academy of Sciences 111.36 (2014): 13111-13116.
Gravel, Dominique, et al. “Reconciling niche and neutrality: the continuum hypothesis.” Ecology letters 9.4 (2006): 399-409.
Gravel, Dominique, Frédéric Guichard, and Michael E. Hochberg. “Species coexistence in a variable world.” Ecology letters 14.8 (2011): 828-839.
Hérault, Bruno. “Reconciling niche and neutrality through the Emergent Group approach.” Perspectives in Plant Ecology, Evolution and Systematics 9.2 (2007): 71-78.
Hubbell, Stephen P. The unified neutral theory of biodiversity and biogeography (MPB-32). Vol. 32. Princeton University Press, 2001.
Lavorel, S., et al. “Plant functional classifications: from general groups to specific groups based on response to disturbance.” Trends in Ecology & Evolution 12.12 (1997): 474-478.
Vellend, Mark. “Conceptual synthesis in community ecology.” The Quarterly review of biology 85.2 (2010): 183-206.
Roughgarden, Joan. “Is there a general theory of community ecology?.”Biology & Philosophy 24.4 (2009): 521-529.
Rosindell, James, et al. “The case for ecological neutral theory.” Trends in ecology & evolution 27.4 (2012): 203-208.
Scheffer, Marten, and Egbert H. van Nes. “Self-organized similarity, the evolutionary emergence of groups of similar species.” Proceedings of the National Academy of Sciences 103.16 (2006): 6230-6235.
Scheiner, Samuel M., and Michael R. Willig. “A general theory of ecology.”Theoretical Ecology 1.1 (2008): 21-28.
Scheiner, Samuel M., and Michael R. Willig. The theory of ecology. University of Chicago Press, 2011.
Wennekes, Paul L., James Rosindell, and Rampal S. Etienne. “The neutral—niche debate: a philosophical perspective.” Acta biotheoretica 60.3 (2012): 257-271.
Werner, EARL E. “Ecological experiments and a research program in community ecology.” Experimental ecology: issues and perspectives (1998): 3-26.
Metacomunidade e quedas orgânicas de mar profundo
Bruno Henrique de Moraes e Souza
A ecologia de comunidades tem como foco o estudo dos padrões de diversidade, abundância e composição das espécies das comunidades e os processos que ditam essas relações que afetam os organismos (Leibold et al. 2004; Vellend, 2010). Na ecologia moderna, um ponto problemático é a dinâmica espacial, onde o movimento dos organismos no espaço afeta seus padrões populacionais assim como sua interação com outras espécies em seu meio (Leibold, 2009). Essa dinâmica está relacionada com a dispersão desses organismos em uma escala regional ou em uma esfera maior (Leibold, 2009). A teoria da biogeografia de ilhas considerou a dispersão realizada pelas espécies, contudo se baseava no fato de que as comunidades seriam abastecidas com organismos oriundos de um continente, não levando em conta diferenças de fitness ou dispersivas (Macarthur; Wilson, 1967). Assim como a teoria neutra, que também não levava em conta essas diferenças entre espécies, e afirma que os organismos vêm de um pool regional para comunidades locais (Hubbell, 2001). Devido a questão levantada pela ecologia moderna e uma melhor abordagem quanto a dispersão foi introduzida a teoria das metacomunidade, que pode ser definida como o conjunto de comunidades locais onde as espécies interagem umas com as outras e com o meio, e que migram entre esses pontos, alterando a demografia desses organismos ao englobar escalas maiores (Wilson, 1992; Leibold et al. 2004). Antes dessas teorias, as comunidades eram tratadas como sistemas isolados e fechados, em que as interações, como a competição e a predação, afetavam as taxas de mortalidade e nascimento, sem levar em conta outras perspectivas, pois estavam focadas apenas na escala local baseados na teoria de nicho (Hutchinson, 1959).
Além disso, a teoria de metacomunidades se apoia em quatro outros conceitos, ou paradigmas, para explicar as interações que ocorrem em ambientes naturais e definir essa abordagem em ecologia de comunidades (Leibold et al. 2004; Holyoak et al. 2005; Vellend, 2010; Logue et al. 2011). O paradigma da “dinâmica de manchas” assume que ocorrem trade-offs entre a capacidade de dispersão e de colonização entre espécies em ambientes heterogêneos, ou seja, melhores dispersoras serão piores competidoras e vice-versa. A abordagem do “efeito de massa” afirma que ambientes heterogêneos ou não são conectados através de alta dispersão possibilitando a persistência de espécies competitivamente inferiores em habitats em que elas tendem a diminuir. A “triagem de espécies” admite que as manchas ambientais possuem caracteristicas ambientais distintas, e que não há limitações à dispersão, permitindo regionalmente a coexistência de espécies devido a diversidade de nichos e diferenças de uso de recursos entre elas. E por fim, o paradigma “neutro”, que coloca que as espécies têm o mesmo nicho e fitness, dependendo apenas de sua estocasticidade demográfica, sendo que as imigrações e especiações teriam um efeito contrário as extinções regionais (Leibold et al. 2004; Holyoak et al. 2005; Vellend, 2010; Logue et al. 2011). Esses conceitos não precisam ocorrer de maneira única nas comunidades, e podem se sobrepor e acontecer simultaneamente, assim como o fato de que os mesmos processos (i. e. diferença de nicho e capacidade de dispersão) estão relacionados a mais de um paradigma, tal ponto é o principal motivo de crítica a teoria de metacomunidades (Vellend, 2010).
O conceito de metacomunidades engloba claramente os mecanismos de dispersão, seleção e deriva (Holyoak et al., 2005), e apesar da especiação não ser visivelmente excluída nessa abordagem, encontra-se ausente nas propostas iniciais que idealizaram esse conceito (Leibold et al., 2004; Vellend, 2010). A especiação também é incorporada ao estudos de metacomunidades quando se leva em consideração, além da escala espacial maior, uma escala maior de tempo, ao apontar a história evolutiva de um organismo (Leibold et al., 2004; Vellend, 2010).
As quedas orgânicas (carcaças de baleia e parcelas de madeira) em fundos oceânicos representam, claramente, o conceito de metacomunidades colocado por Wilson (1992) e Leibold et al. (2004), como um conjunto de comunidades locais. Nesses habitats os organismos das diferentes espécies se dispersam entre essas “ilhas” e interagem entre si, sendo muito dependentes da dispersão de suas larvas planctônicas (Miller, 2006). Uma vez que esses ambientes são efêmeros e a grande maioria dos animais bentônicos é séssil ou possui mobilidade reduzida é vital que possuam uma alta taxa de fecundidade e dispersão para que seja viável encontrar ambientes favoráveis para o desenvolvimento de novas comunidades (Smith, 2005). É interessante colocar que muitos dos animais encontrados nas quedas orgânicas e outro ambientes de mar profundo são especialistas e possuem adaptações para garantir a eficiência na dispersão (Mbari, 2005; Smith, 2015), como o gênero de poliqueta, que se alimenta de ossos, Osedax, do qual o macho microscópico, parasita a fêmea e fornece gametas necessários para a reprodução (Rouse et al., 2004). Essa especialização e adaptação apresentada pela fauna presente dessas comunidades locais é uma maneira de evidenciar que ocorrem especiações nesse ambiente, quando são levadas em consideração escalas temporais maiores, como sugerido por Leibold et al., (2004) e Vellend (2010), e que pode ser incorporada pela teoria de metacomunidades.
Acredita-se que quedas orgânicas funcionem como “stepping stones” para a dispersão dos animais de fontes frias, hidrotermais, e outros habitats quimiossintéticos, além do fato de que parte da fauna encontrada nas carcaças de baleia e parcelas de madeira no fundo marinho são semelhante às desses outros ambientes (Smith & Baco, 2003; Samadi et al., 2007). Essa hipótese também possui implicações evolutivas para esse organismos, sendo que muitas das espécies mais abundantes que possuem simbiontes, encontradas nesse comunidades de mar profundo, evoluíram de ancestrais de águas rasas, provavelmente utilizando as quedas orgânicas como pontos para se fixarem e dispersarem novamente (Distel et al., 2000; Jones et al., 2006). É possível associar essa teoria de “stepping stones” em habitats de mar profundo com a de metacomunidades quando consideramos que nesses ambientes, que são relativamente heterogêneos, por apresentarem características físico-químicas constantes e poucos distúrbios, podem ocorrer os efeitos de massa e de dinâmica de manchas apresentados (Leibold et al. 2004; Holyoak et al. 2005; Vellend, 2010; Logue et al. 2011). Além disso, é um caso em que dispersão, seleção e deriva (Holyoak et al., 2005) estão presentes e que a especiação, apontada por Vellend (2010) como sendo relevante para a ecologia de comunidades, também é existente quando analisa-se as histórias evolutivas da fauna de ambientes profundos.
Uma pergunta relevante considerando a teoria das metacomunidades e minha pesquisa é o fato de que duas comunidades distintas analisadas e que têm características ambientais semelhantes, possuem espécies dominantes diferentes e em uma delas um desses organismos exclui o outro, mesmo com a homogeneidade do habitat. Uma possibilidade é que essa espécie excluída simplesmente não tenha conseguido encontrar esse meio adequada para sua colinização, visto que também não deixou vestígios de ter se fixado, aproximando-se do paradigma da neutralidade (Leibold et al. 2004; Holyoak et al. 2005; Vellend, 2010; Logue et al. 2011). Outra alternativa é que essa espécie que foi pior competidora em um dos pontos, também seja no que ela perdura, estando presente ali apenas por um “efeito de massa” que possibilita que ela resista a competição (Leibold et al. 2004; Holyoak et al. 2005; Vellend, 2010; Logue et al. 2011). Contudo, devido aos poucos estudos realizados em quedas orgânicas de mar profundo, não é possível afirmar se esses organismos possuem nichos distintos ou não. Ao meu ver, é de extrema importância para a ciência que o estudo de ambientes de mar profundo e a ecologia de comunidades se integrem mais de alguma maneira, tendo em vista que muitos dos dados observacionais podem encontrar um fundamento em teorias já levantadas pela ecologia de comunidades, e talvez ainda seria possível testar empiricamente alguns conceitos, e assim encontrar mais respostas e perguntas sobre essa fronteira do conhecimento e ambos os campos de estudo.
Referências bibliográficas
Distel, D.L., Baco, A.R., Chuang, E., Morrill, W., Cavanaugh, C.M., Smith, C.R., 2000. Do mussels take wooden steps to deep-sea vents? Nature 403, 725–726.
Holyoak, M., Leibold, M. A. & Holt, R. D. 2005. Metacommunities: spatial dynamics and ecological communities. University of Chicago Press.
Hubbell, S. P. The unified neutral theory of biodiversity and biogeography. [s.l.] Princeton University Press, 2001.
Jones, W.J., Won, Y.J., Maas, P. a Y., Smith, P.J., Lutz, R.A., Vrijenhoek, R.C., 2006. Evolution of habitat use by deep-sea mussels. Mar. Biol. 148, 841–851.
Logue, J.B.; Mouquet, N.; Peter, H.; Hillebrand, H.; Declerck, P.; Flohre, A.; Gantner, S.; Gulzow, N.G.; Hortnagl, P.; Meier, S. & Pecceu, B. 2009. Empirical approaches to metacommunities: a review and comparison with theory. Trends in Ecology and Evolution, 26(9): 482-491.
Leibold, M.A.; Holyoak, M.; Mouquet, N.; Amarasekare, P.; Chase, J.M.; Hoopes, M.F.; Holt, R.D.; Shurin, J.B.; Law, R.; Tilman, D.; Loreau, M. & Gonzalez, A. 2004. The metacommunity concept: a framework for multi-scale community ecology. Ecology Letters, 7: 601–613.
Leibold. M.A. 2009. Spatial and Metacommunity Dynamics in Biodiversity. In: Levis, S.A. (Ed). The Princeton Guide to Ecology. Princeton, New Jersey. Princeton University Press: 312-319.
Macarthur, R. H.; Wilson, E. O. The Theory of Island Biogeography. [s.l.] Princeton University Press, 1967.
Miller, C.B. Biological Oceanography. EUA: Wiley - Blackwell Publishing, 2006. p. 300-313.
Rouse, G.W., Goffredi, S.K., Vrijenhoek, R.C., 2004. Osedax: bone-eating marine worms with dwarf males. Science 305, 668–671.
Samadi, S.; Quéméré, E.; Lorion, J.; Tillier, A.; von Cosel, R.; Lopez, P.; Cruaud, C.; Couloux, A. & Boisselier-Dubayle, M. 2007. Molecular phylogeny in mytilids supports the wooden steps to deep-sea vents hypothesis. C. R. Biologies 330: 446-56.
Smith, C.R., Baco, A.R., 2003. Ecology of whale-falls at the deep-sea floor. Oceanogr. Mar. Biol. an Annu. Rev. 41, 311–354.
Smith, C. R., Glover, A. G., Treude, T., Higgs, N. D. & Amon, D. J. 2015. Whale-Fall ecosystems: Recent insights into ecology, paleoecology, and evolution. Ann Rev Mar Sci 7, 571–596.
Vellend, M. 2010. Conceptual synthesis in community ecology. The quarterly review of biology, 85(2): 183-206.
Wilson, D.S. 1992. Complex interactions in metacommunities, with implications for biodiversity and higher levels of selection. Ecology 73: 1984–2000.
O nicho entre competição e facilitação
Renan Parmigiani
A evolução do conceito de nicho passou por várias discussões ao longo do último século, Joseph Grinnell foi um dos primeiro a utilizá-lo, no sentido de buscar descrever o “papel” de determinadas espécies no meio, fazendo uma descrição de suas adaptações físicas e comportamentais, e propondo que o nicho é o lugar que a espécie ocupa no ambiente (Grinnell, 1917; Chase & Leibold, 2003). Outra discussão que Grinnell trouxe em suas obras é a possibilidade de haver um nicho vago, ou seja, a ausência de uma espécie que teria plenas condições de sobreviver em um determinado local. Em 1927 Elton trouxe outra abordagem no conceito de nicho, focando no efeito da espécie no ambiente e na cadeia alimentar, enquanto Grinnell propunha o efeito do ambiente nas espécies (Chase & Leibold, 2003). A abordagem de Elton foi utilizada por J. E. Hutchinson na sua definição de nicho, na qual afirma que as espécies possuem um intervalo de valores no eixo de cada variável ambiental (por ex.: temperatura, umidade, insolação), que permite que ela cresça ou se mantenha constante em determinado local. Sendo o nicho o hipervolume formado pelo conjunto de intervalos desses eixos, a Fig 1 mostra o exemplo do nicho de uma espécies, nesse caso o nicho não é um hipervolume, e sim uma área pois há dois eixos ambientais. Dentro da definição de Hutchinson as espécies possuem dois nichos: o primeiro é o nicho fundamental que é a porção do nicho que uma população consegue se manter na ausência de competidores; o segundo é o nicho realizado, que representa uma porção do nicho que não se sobrepõem ao de outras espécies (Hutchinson, 1957; Schoener, 2009).
O conceito de nicho contribui para o melhor entendimento de terorias que já haviam sido cunhadas, sobretudo as envolvendo competição, como por exemplo a experimentação de Gause, que identificou a exclusão competitiva e a coexistência em função da diferenciação de comportamentos alimentícios, ou seja, a diferenciação de nicho gera uma menor competição entre as espécies, permitindo que elas coexistam e aumentem a riqueza de uma comunidade (Gause, 1934; Levine & HilleRisLambers, 2009). Segundo Macarthur e Levins (1967) há um limite de o quanto as espécies podem ser similares para poderem coexistir, caso contrário forças seletivas irão excluir uma das espécies concorrentes. No entanto essa visão de estruturação de uma comunidade baseada na competição e na seleção de nicho não responde a todos os padrões observados na natureza (Ricklefs, 1987), de modo que é necessário incluir outros três processos (deriva, dispersão e especiação) que junto com a seleção estruturam uma comunidade (Velend, 2010).
A ideia que a competição era um dos processos estruturantes de um a comunidade fez com que as interações ecológicas como a facilitação, não estivessem no foco das pesquisas ecológicas, no entanto a facilitação pode ter um papel muito importante na comunidade (Callaway & Walker, 1997). Segundo Bertness e Callaway (1994) em ambientes com um alto estresse físico ou com uma forte pressão de consumo as relações ecológicas positivas (facilitação) tendem a ser encontradas com maior freqüência, já em ambientes com condições abióticas menos severas e menor pressão de consumo há maior frequência da ocorrência de competição, esse padrão é chamado de stress-gradient hypothesis (SGH). A facilitação entre as espécies ocorre muitas vezes devido as suas diferenças de nicho, fazendo com que elas assumam diferentes funções no ambiente (por exemplo: fixar nitrogênio, trazer água de solos profundos para solos rasos, retenção do solo), fazendo com que haja uma complementaridade funcional na comunidade (Loreau & Hector, 2001 Essa idéia de que a facilitação está intimamente ligada a diferenciação de nicho devido a complementaridade funcional, deixa implícita que não há facilitação intra-específica, pois há total sobreposição de nicho, o que também ter por conseqüência o aumento na competição entre os indivíduos. No entanto Fajardo e McIntire (2011) demonstraram que a SGH também se aplica a nível de população, pois em ambientes sobre alto índice de estresse a interação resultante entre os indivíduos era a facilitação, enquanto no outro extremo do gradiente a competição se sobressaia.
O objetivo da minha pesquisa de mestrado é entender como a diversidade de estratégias são afetadas pelo gradiente de estresse edáfico em uma comunidade vegetal de restinga, correlacionando a distribuição de espécies aos mecanismos de filtros ambientais, interações positivas e negativas e o espectro da economia foliar (Leaf Economics Spectrum, LES). Esse espectro é uma forma de analisar quais as estratégias das plantas, pois há determinados padrões correlacionados nas características das folhas das plantas, por exemplo: quantidade de nitrogênio, fósforo, vida útil da folha (Wright et. al, 2004). Pensava-se que para cada comunidade há um trait ótimo para as espécies conseguirem se estabelecerem, no entanto há várias possibilidades a serem exploradas, ou seja, a diferenciação de nicho das espécies as fazem explorar diferentes possibilidade de traits no LES (Laughlin et. al, 2015).
A hipótese do meu trabalho é que há uma convergência de estratégias em lugares mais estressados, pois a seleção por fatores abióticos nesses lugares é tão intensa que apenas as espécies que possuem certas características de nicho (ou também traits no LES) conseguem se estabelecer, ou seja, há uma maior sobreposição de nicho das espécies que compõem esse ambiente. Já nos ambientes menos estressados há maior competição entre as espécies, pois não há um filtro ambiental abiótico tão forte, havendo a necessidade de uma diferenciação de nicho das espécies presentes nesse local para que elas possam coexistir. Caso essa minha hipótese seja verdadeira, e partindo da premissa da SGH que há uma relação direta entre estresse e frequência da facilitação entre os indivíduos (Bertness & Callway, 1994), nos lugares mais estressados haverá maior sobreposição de nicho das espécies, no entanto a interação mais comum entre elas não será a competição e sim a facilitação.
Referências bibliográficas
Bertness, M. D.; Callaway, R. M. Positive interactions in communities. TREE, vol. 9, no. 5, p. 191-193, 1994.
Callaway, R. M.; Walker, L. R., Competition and Facilitation: A Synthetic Approach to Interactions in Plant Communities. Ecology, vol. 78, no. 7, p. 1958-1965, 1997 Chase, J. M.; Leibold, M. A. Ecological niches, linking classical and contemporary approaches. Chicago, Chicago University Press. 2003.
Laughlin, D. C.; Joshi, C.; Richardson, S. J.; Peltzer, D. A.; Mason, N. W. H.; Wardle, D. A. Quantifying multimodal trait distributions improves trait-based predictions of species abundances and functional diversity. Journal of Vegetation Scince, vol. 26, p. 46-57. 2015
Fajardo, A.; McIntire, E. J. B. Under strong niche overlap conspecifics do not compete but help each other to survive: facilitation at the intraspecific level. Journal of Ecology, vol. 99, p. 642-650, 2011.
Gause, G.F. 1934. The struggle for existence. Williams and Wilkins Co. Disponível em http://www.ggause.com/Contgau.htm
Grinnell, J. The niche relationships of the California thrasher. Auk, vol. 34, p. 427-433, 1917.
Hutchinson, G. E. Concluding remarks. Cold Spring Harbor Symposium on Quantitative Biology, vol. 22, p. 415-427, 1957.
Levine , J. M.; HilleRisLambers J. The importance of niches for the maintenance of species diversity. Nature, vol. 461, p. 254-257, 2009.
Loreau, M.; Hector, A. Partitioning selection and complementarity in biodiversity experiments. Nature, vol. 412, p. 72-77, 2001.
MacArthur R.; Levins, R. The limiting similarity, convergence and divergence of coexisting species. The American Naturalist, vol. 101, p. 377-385, 1967.
Ricklefs, R. Community diversity: relative roles of local and regional processes. Science, vol. 235, n. 4785, p. 167-171, 1987.
Shoener, T. W. Ecological niche. In: LEVINS, S.A. (Ed.). The Princeton Guide to Ecology. Princeton and Oxford: Princeton University Press, 2009. 842p.
Vellend, M. Conceptual synthesis in community ecology. The Quarterly review of biology, v. 85, n. 2, p. 183–206, 2010.
Wright, I. J., et. al. The worldwide leaf economics spectrum. Nature, vol. 428, p. 821-827, 2004.
Resiliência e inércia social na lacuna entre ciência e prática em Ecologia
Diana Bertuol Garcia
Sistemas dinâmicos apresentam equilíbrios estáveis quando pequenas alterações em torno de um estado fazem o sistema retornar ao estado inicial. Quando o sistema converge para o mesmo estado independentemente das condições iniciais, há um único equilíbrio, situação que poderia ser representada por uma paisagem de estabilidade como a da Figura 1a1). Muitas vezes, porém, sistemas naturais e sociais podem apresentar comportamentos mais complexos, com dois ou mais possíveis equilíbrios estáveis, ou estados alternativos, sob as mesmas condições [1]. Tal situação poderia ser representada por uma paisagem de estabilidade com dois vales, ou bacias de atração (Figura 1b). Se a bola está no centro de uma bacia, um pequeno distúrbio a faz voltar à condição inicial, enquanto um distúrbio maior pode levá-la a outra bacia, e, portanto, ao outro estado de equilíbrio. Quando isso ocorre, diz-se que ocorreu uma transição crítica [1]. Quanto maior for a bacia de atração, maior a chance de o sistema voltar ao seu estado inicial após uma perturbação (e, portanto, menor a chance de uma transição crítica). Assim, o tamanho da bacia de atração está relacionado ao que chamamos de resiliência do sistema: a perturbação máxima que um sistema pode receber sem que ocorra uma mudança para outro estado alternativo [1,2].
![Figura 1. Paisagens de estabilidade para sistemas com um estado de equilíbrio (a) ou dois estados de equilíbrio alternativos (b). A bola representa o sistema; a posição da bola, o estado do sistema e a inclinação na paisagem, a taxa de mudança do sistema. Assim, onde a inclinação é nula o sistema se encontra em equilíbrio. Um vale pode também ser chamado de bacia de atração, pois o sistema é atraído pelo equilíbrio no fundo do vale. Modificado de [1]. Figura 1. Paisagens de estabilidade para sistemas com um estado de equilíbrio (a) ou dois estados de equilíbrio alternativos (b). A bola representa o sistema; a posição da bola, o estado do sistema e a inclinação na paisagem, a taxa de mudança do sistema. Assim, onde a inclinação é nula o sistema se encontra em equilíbrio. Um vale pode também ser chamado de bacia de atração, pois o sistema é atraído pelo equilíbrio no fundo do vale. Modificado de [1].](/bie5778/lib/exe/fetch.php?w=300&tok=198a3b&media=ensaios:bacias_de_atracao.png)
Em sistemas ecológicos, a existência de estados alternativos foi proposta a partir de estudos teóricos sobre interações de espécies em diferentes níveis tróficos [2,3]. Apesar de críticas iniciais às primeiras evidências, diversos estudos subsequentes demonstraram fortemente a existência de transições críticas e estados alternativos em ecossistemas variados [4]. Alguns exemplos são lagos de águas claras ou turvas [5,6], recifes dominados por corais ou algas [7,8] e florestas, savanas e campos [9]. Com essas demonstrações, o estudo de sistemas dinâmicos em Ecologia, antes focado em equilíbrios locais e modelos determinísticos, voltou-se para equilíbrios globais e fatores históricos e estocásticos que poderiam determinar em qual equilíbrio o sistema se encontra [2,3].
Os mecanismos biológicos responsáveis pela existência de estados alternativos são feedbacksinternos ao sistema [4,10]. feedbackspositivos conduzem o sistema para um ou outro estado, sendo responsáveis pela existência de estados alternativos [1,10]. Em lagos rasos, por exemplo, feedbackspositivos entre macroalgas e transparência da água mantém o sistema ou com águas claras e dominância de macroalgas ou com águas turvas sem macroalgas. [5,6]. Já feedbacksnegativos tendem a manter o sistema em um estado de equilíbrio [10], e geram, portanto, a resiliência de um estado. Assim, um estado de equilíbrio pode se manter mesmo com alterações nas condições ambientais.
De fato, as transições críticas já documentadas foram em geral desencadeadas por eventos estocásticos, como patógenos ou fogos, sem que o ecossistema apresentasse mudanças aparentes em resposta a alterações nas condições ambientais [1,4]. Isso ocorre porque a resiliência é uma propriedade dinâmica desses sistemas, que pode ser alterada pelas condições ambientais [1,11]. Fatores externos podem alterar a paisagem de estabilidade e acarretar perda de resiliência, pois diminuem o tamanho da bacia de atração, como apresentado na Figura 2. Partindo do painel inferior, mudanças graduais nas condições ambientais não alteram o estado do sistema, que permanece na mesma bacia de atração, mas erodem a resiliência, pois a bacia se torna cada vez menor [1,4]. Numa situação crítica, como no quarto painel, a resiliência do sistema é tão baixa que pequenas perturbações estocásticas no sistema ou nas condições ambientais ocasionam uma transição crítica para a outra bacia de atração [1,4]. Para retornar ao estado inicial, é necessário restaurar as condições ambientais a valores muito anteriores aos que resultaram na primeira transição (na Figura 2, é necessário retornar ao segundo painel), fenômeno chamado de histerese [1]. Assim, ecossistemas dinâmicos com estados múltiplos apresentam respostas não lineares a mudanças graduais em condições externas [1].
![Figura 2. Representação do efeito de condições externas em uma paisagem de estabilidade. O painel amarelo representa os pontos de equilíbrio estáveis (fundos de vale, linha contínua) e instáveis (picos entre vales, linha pontilhada) para as diferentes condições ambientais. F1 e F2 representam os pontos em que as transições críticas do sistema ocorrem e a flecha representa a perturbação que gera a transição. Fonte: [4]. Figura 2. Representação do efeito de condições externas em uma paisagem de estabilidade. O painel amarelo representa os pontos de equilíbrio estáveis (fundos de vale, linha contínua) e instáveis (picos entre vales, linha pontilhada) para as diferentes condições ambientais. F1 e F2 representam os pontos em que as transições críticas do sistema ocorrem e a flecha representa a perturbação que gera a transição. Fonte: [4].](/bie5778/lib/exe/fetch.php?w=300&tok=3e4917&media=ensaios:paisagens.png)
Embora sistemas sociais sejam diferentes dos naturais em muitos aspectos, como a importância de aprendizado e inovação, respostas não lineares e transições críticas são comumente encontrados nesses sistemas [1]. Quebras de bolsas e colapsos de sociedades sem nenhum determinante ambiental aparente são exemplos de mudanças bruscas inesperadas [1]. A opinião e a atitude pública também parecem apresentar mudanças bruscas ao invés de mudanças graduais, com diversos exemplos na moda, tabagismo, dinâmicas de crimes e mudanças de paradigmas científicos [12–14].
A existência de transições críticas em sistemas sociais implica que esses sistemas podem permanecer em determinado estado por certo tempo, apesar de mudanças graduais nas condições externas, apresentando assim certa resiliência. Em grupos sociais, esse fenômeno é chamado de inércia social e pode explicar por que sociedades demoram para responder a novos problemas [15]. Em um modelo simples da dinâmica de opiniões em grupos, pessoas podem ter uma atitude passiva ou ativa em relação a um problema (i.e. se alguma ação deve ou não ser feita para minimizá-lo), mas existe um custo em tomar uma atitude diferente da do grupo, ou seja, há o que os autores chamam de peer pressure [15]. Essa situação resulta em uma dinâmica de estado alternativos, em que o grupo permanece num estado inerte passivo enquanto a seriedade percebida do problema aumenta, até um ponto crítico em que há uma transição brusca para um estado ativo (Figura 3a; [15]). O grau de inércia desse sistema é maior conforme aumenta a pressão do grupo, a complexidade do problema, a homogeneidade da população (todos apresentam a mesma atitude em resposta à seriedade do problema e à pressão do grupo) e a ausência de líderes (Figura 3b; [15]).
![Figura 3. Modelo simples de opinião pública em que há duas atitudes possíveis (ativa e passiva) e um custo em tomar uma atitude diferente da do grupo (peer pressure). (a) A figura é similar àquela do painel inferior da Figura 2, mostrando que o sistema pode apresentar histerese e dois estados alternativos em resposta a seriedade percebida do problema. (b) A figura mostra como o grau de histerese varia com mudanças em outras variáveis externas. Fonte: [15]. Figura 3. Modelo simples de opinião pública em que há duas atitudes possíveis (ativa e passiva) e um custo em tomar uma atitude diferente da do grupo (peer pressure). (a) A figura é similar àquela do painel inferior da Figura 2, mostrando que o sistema pode apresentar histerese e dois estados alternativos em resposta a seriedade percebida do problema. (b) A figura mostra como o grau de histerese varia com mudanças em outras variáveis externas. Fonte: [15].](/bie5778/lib/exe/fetch.php?w=750&tok=081c78&media=ensaios:fig3_diana.png)
A relação entre a ciência ecológica e a prática2) possui diversas características que indicam inércia social impedindo ambos os lados de saírem de um estado em que o conhecimento ecológico não é aplicado para solucionar problemas reais ou apoiar a tomada de decisão. Apesar dessa desconexão entre ciência e prática - comumente conhecida como lacuna ciência-prática - ter sido identificada na Ecologia já na década de 90 [16–21], ela continua aparecendo na literatura como um problema atual em diferentes campos ecológicos [22–27]. Tal persistência por mais de duas décadas pode indicar inércia social. Os argumentos a seguir focam alguns fatores presentes no lado científico, não só por questões de simplificação, mas também por que os aspectos sociais da produção científica são mais facilmente encontrados na literatura. No entanto, a perspectiva da prática e outros fatores que influenciam a lacuna ciência-prática são igualmente importantes para analisar de maneira mais abrangente a possibilidade de inércia social nesse sistema.
É possível imaginar um modelo similar ao apresentado na figura 3, na qual o eixo x seria a seriedade percebida do problema da lacuna ciência-prática em Ecologia e o eixo y seria a porcentagem de cientistas que realizam atividades de aproximação com a prática3) (seja disseminação e tradução de ciência ou participação em atividades de integração de conhecimento científico e prático). A pressão do grupo surgiria a partir do sistema de avaliação de cientistas, que valoriza especialmente publicação de artigos científicos em jornais de alto impacto e não incentiva qualquer atividade de aproximação com a prática [28–31]. Esse sistema de avaliação funcionaria como um feedback negativo ao sistema, em que qualquer cientista que buscasse realizar atividades de aproximação dedicaria menos tempo à publicação de artigos, seria pior avaliado na carreira e, para se manter como cientista, seria incentivado a diminuir a participação em atividades de aproximação. Quanto mais fortes forem os feedbacksinternos ao sistema, maior a chance do sistema apresentar dois estados alternativos [1]. O fato de que o sistema de avaliação de cientistas apareça com frequência na literatura científica como um fator gerando distanciamento entre ciência e prática [32, em preparação] indica que esse feedback é forte e que, portanto, pode gerar um estado de lacuna ciência-prática resiliente.
Além disso, no modelo da Figura 3, se as pessoas respondem de maneira idêntica (população homogênea) à seriedade do problema e à pressão do grupo, o sistema tende a permanecer em inércia [15]. Mas se cada pessoa responde de maneira diferente da outra, o sistema muda gradualmente, sem apresentar inércia [15]. No caso da lacuna ciência-prática, a educação formal científica pode ser entendida como um fator gerando homogeneidade da população, pois não abrange processos e métodos usados na prática nem habilidades de comunicação e interação [33–35]. Isso resultaria numa população homogênea de cientistas sem capacidade de realizar atividades de aproximação com a prática e que, portanto, não realizaria tais atividades, permanecendo em inércia social.
Por último, a complexidade do problema também aumenta a histerese para o sistema social descrito acima, pois aumenta a dificuldade de que pessoas formem opiniões e tomem atitudes com base em experiências próprias, tornando-as mais dependentes de pressões do grupo [1]. A grande diversidade de causas citadas e uma diversidade de perspectivas sobre a lacuna ciência-prática indica que este é problema complexo e multifacetado [32, em preparação]. Assim, a situação apresentada sugere grande potencial de inércia social, devido a intensas pressões de grupo, homogeneidade da população e grande complexidade do problema.
O arcabouço de sistemas com múltiplos estados oferece também ferramentas para pensar como sair de situações indesejáveis de inércia, promovendo transições críticas positivas. Uma opção é erodir a resiliência do sistema até um ponto em que uma pequena força resulte numa mudança brusca e numa transição para um estado alternativo desejável [1]. Para o sistema da lacuna ciência-prática apresentado, no entanto, uma opção mais viável seria transitar para um sistema com mudanças graduais, ao diminuir a pressão do grupo e a homogeneização da população. Poderiam ser estabelecidos sistemas de avaliação que valorizem impacto real da ciência na prática [28,36], processos e produtos de transferência de conhecimento [37] e diferentes carreiras acadêmicas [31]. Em conjunto com uma educação formal que desenvolvesse habilidades necessárias para a aproximação com a prática, os cientistas se sentiriam aptos a realizar tais atividades e não sofreriam custos na carreira. Com isso, criar-se-ia uma situação em que um aumento na percepção da seriedade do problema geraria aumento na disposição em realizar atividades de aproximação, que, por ausência de restrições de carreira, poderiam ser efetivamente realizadas. No entanto, é importante ressaltar que o estado ideal aqui almejado não é aquele em que todos cientistas interagem com a prática, mas um estado em que cada cientista é livre (i.e. não enfrenta barreiras) para realizar ou não atividades de aproximação. Tal diversidade de oportunidades gera maior capacidade de adaptação e inovação, diminuindo o risco de que o sistema fique preso novamente em inércia [1].
No entanto, não se deve ignorar a possibilidade de que o sistema se encontre numa etapa anterior, em que a seriedade do problema percebida entre os cientistas é tão baixa que só há um estado de equilíbrio possível, no qual não há aproximação com a prática. Isso aponta para a importância de líderes formadores de opinião que tragam à tona a seriedade do problema e incentivem à ação [15]. Caso a situação com dois equilíbrios seja alcançada, tais líderes também diminuem a probabilidade de inércia [15]. Na Ecologia, a importância de líderes e de uma educação para liderança já foi apontada como fundamental para a aproximação entre ciência e prática [38].
Desta maneira, a persistência do problema da lacuna ciência-prática em Ecologia pode ser resultado de uma inércia social causada por pressões do sistema de avaliação de cientistas, pela homogeneização que resulta da educação formal científica e pela complexidade do problema. Tal argumento resulta de uma simplificação a partir da perspectiva dos cientistas; o sistema pode apresentar comportamentos diferentes sob a perspectiva da prática e quando outros mecanismos são incorporados. Ainda assim, a análise sob a ótica de resiliência e inércia em sistemas sociais auxilia a identificar possíveis caminhos para a aproximação entre ciência e prática em Ecologia, como a modificação dos sistemas de avaliação e da educação formal e a necessidade de líderes formadores de opinião.
Referências bibliográficas
1. Scheffer, M. (2009). Critical Transitions in Nature and Society. Princeton University Press.
2. Holling, C. S. (1973). Resilience and stability of ecological systems. Annual review of ecology and systematics: 1–23.
3. May, R. M. (1977). Thresholds and breakpoints in ecosystems with a multiplicity of stable states. Nature 269(5628): 471–477.
4. Scheffer, M., Carpenter, S., Foley, J. A., Folke, C. & Walker, B. (2001). Catastrophic shifts in ecosystems. Nature 413(6856): 591–596.
5. Blindow, I., Andersson, G., Hargeby, A. & Johansson, S. (1993). Long-term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology 30(1): 159–167.
6. Scheffer, M., Hosper, S. H., Meijer, M.-L., B. Moss & Jeppesen, E. (1993). Alternative Equilibria in Shallow Lakes. Trends in Ecology & Evolution 8(8): 275–279.
7. Knowlton, N. (1992). Thresholds and multiple stable states in coral reef community dynamics. American Zoologist 32(6): 674–682.
8. Hughes, T. P. (1994). Catastrophes, phase shifts, and large-scale degradation of a Caribbean coral reef. Science 265(5178): 1547–1551.
9. Hirota, M., Holmgren, M., Nes, E. H. V. & Scheffer, M. (2011). Global Resilience of Tropical Forest and Savanna to Critical Transitions. Science 334(6053): 232–235.
10. Berryman, A. A. (1989). The conceptual foundations of ecological dynamics. Bulletin of the Ecological Society of America 70(4): 230–236.
11. Beisner, B. E., Haydon, D. T. & Cuddington, K. (2003). Alternative stable states in ecology. Frontiers in Ecology and the Environment 1(7): 376–382.
12. Brock, W. A. & Durlauf, S. N. (1999). A formal model of theory choice in science. Economic Theory 14(1): 113–130.
13. Scheffer, M. & Westley, F. R. (2007). The evolutionary basis of rigidity: locks in cells, minds, and society. Ecology and Society 12(2): 36.
14. Gladwell, M. (2009). O Ponto Da Virada. Sextante.
15. Scheffer, M., Westley, F. & Brock, W. (2003). Slow Response of Societies to New Problems: Causes and Costs. Ecosystems 6(5): 493–502.
16. Livingston, R. J. (1991). Historical Relationships between Research and Resource-Management in the Apalachicola River Estuary. Ecological Applications 1(4): 361–382.
17. Finch, D. M. & Patton-Mallory, M. (1993). Closing the Gap between Research and Management. Status and Management of Neotropical Migratory Birds 229: 12–16.
18. Patten, D. (1993). Integrating Science and Decision-Making. Riparian Management: Common Threads and Shared Interests: A Western Regional Conference on River Management Strategies 226: 167–172.
19. Kirchhoff, M. D., Schoen, J. W. & Franklin, T. M. (1995). A Model for Science-Based Conservation Advocacy - Tongass-National-Forest Case-History. Wildlife Society Buletin 23(3): 358–364.
20. Underwood, A. J. (1995). Ecological Research and (and Research into) Environmental-Management. Ecological Applications 5(1): 232–247.
21. Dovers, S. R., Norton, T. W. & Handmer, J. W. (1996). Uncertainty, ecology, sustainability and policy. Biodiverity Conservation 5(10): 1143–1167.
22. Anonymous. (2007). The great divide. Nature 450(7167): 135–136.
23. Knight, A. T. et al. (2008). Knowing but not doing: Selecting priority conservation areas and the research-implementation gap. Conservation Biology 22(3): 610–617.
24. Cabin, R. J., Clewell, A., Ingram, M., McDonald, T. & Temperton, V. (2010). Bridging Restoration Science and Practice: Results and Analysis of a Survey from the 2009 Society for Ecological Restoration International Meeting. Restoration Ecology 18(6): 783–788.
25. Esler, K. J., Prozesky, H., Sharma, G. P. & McGeoch, M. (2010). How wide is the ‘knowing-doing’ gap in invasion biology? Biological Invasions 12(12): 4065–4075.
26. Barmuta, L. A., Linke, S. & Turak, E. (2011). Bridging the gap between ‘planning’ and ‘doing’ for biodiversity conservation in freshwaters. Freshwater Biology 56(1): 180–195.
27. Pardini, R., Rocha, P. L. B., El-Hani, C. & Pardini, F. (2013). In: Raven, P. H., Sodhi, N. S. & Gibson, L. Conservation Biology: Voices from the Tropics (2013). 1–24.
28. Shanley, P. & López, C. (2009). Out of the loop: why research rarely reaches policy makers and the public and what can be done. Biotropica 41(5): 535–544.
29. Born, J., Boreux, V. & Lawes, M. J. (2009). Synthesis: Sharing Ecological Knowledge-The Way Forward. Biotropica 41(5): 586–588.
30. Sunderland, T., Sunderland-Groves, J., Shanley, P. & Campbell, B. (2009). Bridging the Gap: How Can Information Access and Exchange Between Conservation Biologists and Field Practitioners be Improved for Better Conservation Outcomes? Biotropica 41(5): 549–554.
31. Whitmer, A. et al. (2010). The engaged university: providing a platform for research that transforms society. Frontiers in Ecology and the Environment 8(6): 314–321.
32. Garcia, D. B., Morsello, C., El-Hani, C. & Pardini, R. (2016). A conceptual framework of causes of the science-practice gap in Ecology (em preparação).
33. Cannon, J. R., Dietz, J. M. & Dietz, L. A. (1996). Training conservation biologists in human interaction skills. Conservation Biology 10(4): 1277–1282.
34. Jacobson, S. K. & Duff, M. D. (1998). Training idiot savants: the lack of human dimensions in conservation biology. Conservation Biology 12(2): 263–267.
35. Baxter, G., Hockings, M., Carter, R. & Beeton, R. (1999). Trends in wildlife management and the appropriateness of Australian university training. Conservation Biology 13(4): 842–849.
36. Arlettaz, R. et al. (2010). From Publications to Public Actions: When Conservation Biologists Bridge the Gap between Research and Implementation. BioScience 60(10): 835–842.
37. Holi, M. T. (2008). Metrics for the Evaluation of Knowledge Transfer Activities at Universities.
38. Manolis, J. C. et al. (2009). Leadership: a New Frontier in Conservation Science. Conservation Biology 23(4): 879–886.
Mr. Vellend, onde se encaixa o efeito antropogênico no seu framework?
Camila A. Islas
A ecologia de comunidades tem, tradicionalmente, buscado compreender o que causa as diferenças nos padrões de diversidade entre as comunidades (Loreau 2009). Há algum tempo, pesquisadores discutem sobre a necessidade, vantagens e desvantagens de uma teoria geral para a ecologia de comunidades (Lawton 1999; Roughgarden 2009; Vellend 2010). Em 2010, Vellend publicou um artigo no qual propõe organizar o conhecimento gerado até então na área, por meio de um framework conceitual. Pela primeira vez, a seleção, a deriva, a especiação e a dispersão são apontados como os quatro principais processos atuando sobre as comunidades e gerando os padrões de diversidade que observamos.
A seleção e a deriva são processos que afetam a abundância relativa das espécies que existem em uma comunidade (McPeek and Gomulkiewicz 2005). A seleção, como um processo que opera sobre as comunidades, atua, em geral, sobre a identidade de um indivíduo e não sobre suas características específicas. Nesse contexto, a seleção pode ser compreendida como uma diferença de aptidão(fitness) entre indivíduos de distintas espécies (Vellend). Quando essa diferença de aptidão reflete nas taxas com que os indivíduos deixam descendentes, a seleção favorece aquele que deixa descendentes em maior taxa (Bell 2008). A competição, a predação e a diferença no uso dos recursos caracterizam-se como algumas das formas com que a seleção atua nas comunidades (Vellend and Orrock 2009). Em contraste, a deriva pode ser conceituada como mudanças randômicas na abundância relativa das espécies (Vellend 2010). Em teoria, a deriva ecológica ocorre quando não existe diferença demográfica ou competitiva entre indivíduos de espécies díspares, o que leva invariavelmente todas as espécies, menos uma, a extinção (Hubbel 2001, p. 57). Esse cenário teórico em geral não acontece. No entanto, qualquer comunidade que possua um número finito de indivíduos possui um componente estocástico (e.g. taxas de nascimento e morte) (McPeek and Gomulkiewicz 2005). Na interação entre os processos de seleção e deriva encontra-se a extinção como um possível produto.
A especiação e a dispersão são processos que, em grandes escalas de espaço e tempo, adicionam espécies às comunidades (Ricklefs 1987). A especiação é entendida, objetivamente, como a criação de novas espécies (Vellend 2010). Caracteriza-se como um processo pelo qual uma seleção divergente dentro de uma mesma espécie evolui barreiras ao fluxo gênico entre populações (Nossil 2012). Atualmente, considera-se que existe um continuo de variação no processo de especiação, que varia desde “indivíduos de uma população que variam entre si” até “populações diferentes” (Nossil 2012). A especiação pode ocorrer por meio de quatro processos diferentes: alopátrico, parapátrico, peripátrico e simpátrico, dos quais dois serão discutidos a seguir. Por fim, chama-se dispersão o movimento dos organismos por meio do espaço. A dispersão, localmente, conecta indivíduos entre comunidades de uma metacomunidade (Leibold, 2009). Assim, um fluxo maior de indivíduos pode impedir o isolamento e a extinção de uma comunidade, enquanto que um fluxo menor pode ocasionar o contrário. Nesse contexto, a composição e o tamanho das comunidades existentes têm influência direta sobre as dinâmicas de dispersão (Holyoak et al. 2005). Por exemplo, quanto maior o conjunto (pool) regional de espécies, maior o número de espécies que podem dispersar entre comunidades.
Não pretendo aqui exaurir as discussões sobre as definições e as implicações nas comunidades ecológicas dos quatro processos apresentados por Mark Vellend, tão pouco, debater sobre a importância desses conceitos para a teoria ecológica. Proponho um ensaio menos óbvio, mas não menos interessante. A ideia vem de um cenário fictício no qual eu pudesse defrontar o autor sobre seu artigo. Certamente lhe parabenizaria pela proposta de organizar uma área, a tanto tempo, conhecida como “bagunçada”. Ainda assim, o indagaria: Mr. Vellend, onde se encaixa o efeito antropogênico* no seu framework?
Possivelmente, a omissão do efeito antrópico no framework de Vellend não resulta apenas de um inoportuno esquecimento. Trata-se, ao meu ver, de um reflexo histórico sintomático. Desde o início do seu desenvolvimento até poucos anos atrás, a ecologia (clássica) voltou seus esforços, quase que exclusivamente, para compreender as interações consideradas “naturais” entre organismos e seu ambiente (Egerton 1983; Janx 2011), muito devido a sua origem naturalista (Van Dyke 2008), resistindo em integrar os efeitos antropogênicos em suas pesquisas e corpo teórico (Vitousek 1994; Berkes & Folke 1998; Alberti et al. 2003; Likens & Cronon 2012). A existência de uma ecologia aplicada, que tenta resolver os problemas causados pelo ser humano com o conhecimento ecológico, é a algum tempo reconhecida, mas a compreensão de que os efeitos antropogênicos afetam os sistemas naturais e vice-versa de forma que implicam diretamente às teorias ecológicas raramente é considerada (Berkes & Folke 1998; Likens & Cronon 2012). O sumário dos principais livros textos da área (Begon 2009; Levin et al. 2009; Ricklefs 2010) registram esse cenário, nos quais primeiro é apresentado ao leitor o conhecimento teórico sobre as interações naturais e somente ao final surgem capítulos que tratam de áreas que incorporam os efeitos antropogênicos, ainda que a partir de uma visão tecnicista.
Providencialmente, existem diversas áreas dentro da ecologia que, nas últimas décadas, tem se esforçado para integrar o conhecimento ecológico aos efeitos antropogênicos (embora algumas o façam desde os anos 20!). Algumas áreas que merecem destaque são ecologia humana, ecologia aplicada, gestão de recursos naturais de uso comum ecologia da paisagem, biologia da conservação e ecologia de ecossistemas (pela incorporação de conceitos como o de sistemas socioecológicos e de manejo de base ecossistêmica). Em contraste, a ecologia de comunidades encontra-se dentre as disciplinas que menos incorporam os efeitos antropogênicos em seu corpo teórico. Prova disso é que nenhuma das grandes discussões da ecologia de comunidades pautadas nas últimas décadas (e.g. teoria neutra, processos históricos e biogeográficos), tampouco artigos que fazem revisões gerais da área (Roughgarden 2009; Vellend and Orrock 2009), tratam dos efeitos antropogênicos sobre as comunidades. Se considerarmos que a espécie humana se tornou uma espécie “invasora” na maioria dos ambientes e competitivamente dominante, como é possível ignorar seus efeitos no corpo teórico da ecologia de comunidades, quando estes afetam profundamente as comunidades biológicas?
Neste contexto, o framework apresentado por Vellend (2010), se apresenta como uma oportunidade para introduzir os efeitos antropogênicos na teoria da ecologia de comunidades. Para isso, é importante identificar sob quais conceitos do framework estes efeitos operam. A interação mais óbvia é a ação direta dos efeitos antropogênicos sobre os processos de seleção, deriva, especiação e dispersão e, consequentemente, o efeito dominó que geram sobre a caixa preta da ecologia de comunidades e os padrões ecológicos (Fig. 1).
 Fig. 1 – Proposta de inclusão dos efeitos antropogênicos na figura que trata sobre a “Caixa preta da ecologia” de Vellend (2010).
Fig. 1 – Proposta de inclusão dos efeitos antropogênicos na figura que trata sobre a “Caixa preta da ecologia” de Vellend (2010).
Em muitas comunidades a espécie humana age como predador e competidor das espécies que compõe a comunidade (Castilla 1999; Ciuti et al. 2012). Em comunidades marítimas, por exemplo, o ser humano se alimenta das espécies de diversos níveis tróficos e compete com os peixes carnívoros (Castilla 1999). A espécie humana, ainda, atua como “engenheira de ecossistemas”, modificando profundamente os habitats das espécies (Smith 2007). Os efeitos antropogênicos nestes casos atuam diretamente sobre a seleção das espécies, podendo favorecer a persistência de uma espécie (e.g. espécies generalistas em ambientes fragmentados) ou causando a diminuição populacional de uma espécie (e.g. caça) e, até mesmo, sua extinção. Os efeitos antropogênicos podem, ainda, afetar a interação entre deriva e seleção nas comunidades. De acordo com Vellend (2010), se a seleção é forte e o tamanho da comunidade é grande, a seleção supera os efeitos da deriva. Enquanto que, se a seleção é fraca e o tamanho da comunidade é pequeno, a deriva supera os efeitos da seleção. Assim, por exemplo, se os efeitos antropogênicos aumentam a pressão seletiva sobre uma comunidade de tamanho grande, os efeitos da deriva serão superados pela seleção. Porém, se a pressão for tão forte que venha a diminuir a comunidade a um tamanho muito pequeno, então os efeitos da deriva podem se sobressair e causar a extinção local de uma espécie.
Os efeitos antropogênicos podem, sobretudo, afetar a existência e a chegada das espécies em uma comunidade. Ainda que uma espécie possua capacidade biológica de se dispersar para um ambiente, efeitos antropogênicos podem determinar se e em que quantidade a dispersão da espécie vai ser bem-sucedida (Helmus et al. 2014). Modificações intensas do ambiente (e.g. construção de rodovias, abertura de barreiras naturais) podem viabilizar, aumentar, diminuir ou impossibilitar totalmente a dispersão de uma espécie para determinado local. Nesse caso, os efeitos antropogênicos podem, até mesmo, isolar uma comunidade completamente e proporcionar sua extinção ou processos de especiação (Wu, 2009). Pelo menos dois tipos de especiação conhecidos (alopátrica e parapátrica) podem ser causados pela ação humana (Allendorf et al. 2001). A especiação alopátrica ocorre quando uma população é dividida por uma barreira física, e pode ser causada pela modificação do ambiente pelo ser humano (e.g. desvio de um rio). A especiação paripátrica ocorre quando a população diverge na sua distribuição geográfica sem a presença de barreira física, e pode resultar de uma ação humana que modifique o ambiente de tal forma que uma parte da população se beneficie mais no novo ambiente do que a outra (e.g. desmatamento de uma floresta, em que a dispersão de uma parte da população seja dificultada, mas favoreça a dispersão de outra parte). Efeitos antropogênicos podem, ainda, causar hibridização ao unir espécies capazes de cruzarem entre si que estavam separadas geograficamente (e.g. introdução de Leontopithecus chrysomelas em locais onde só existiam L. rosalia), diminuindo assim o pool regional de espécies.
Finalizando este assunto, sem de forma alguma exauri-lo, é possível que a inserção dos efeitos antropogênicos na ecologia de comunidades amplie a visão da disciplina, de forma semelhante ao que a inclusão da perspectiva histórica e biogeográfica proporcionou a área. Esta perspectiva se fortalece quando visualizamos como os efeitos antropogênicos podem atuar nas comunidades em escala local, regional e global (Fig. 2). Não obstante, vale a pena destacar que a influência da espécie humana nos quatro principais processos que influenciam as comunidades constitui apenas uma pequena parte dos efeitos antropogênicos que atuam sobre as comunidades ecológicas como um todo (Fig. 1), mas um desenvolvimento mais aprofundado destas questões carece de um outro ensaio.
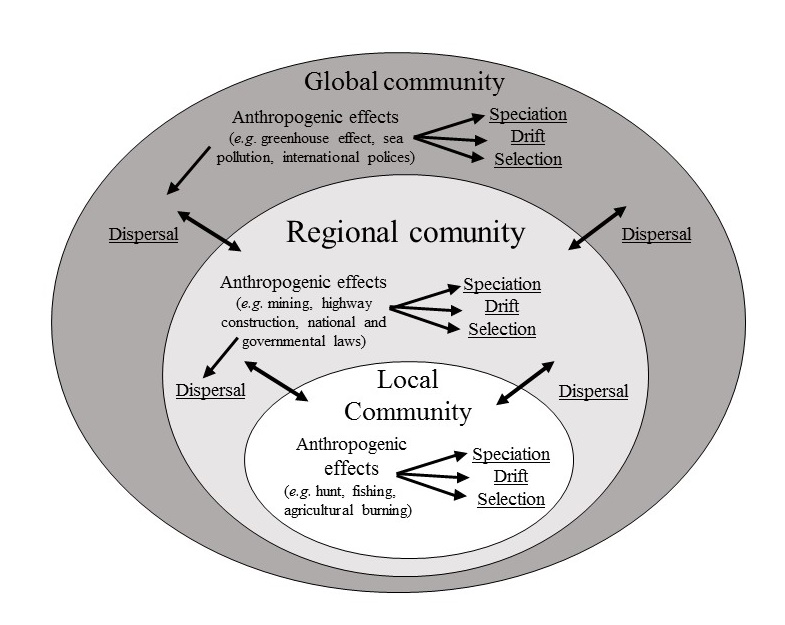 Fig. 2 – Proposta de inclusão dos efeitos antropogênicos na figura que trata sobre a “Teoria da ecologia de comunidades” de Vellend (2010).
Fig. 2 – Proposta de inclusão dos efeitos antropogênicos na figura que trata sobre a “Teoria da ecologia de comunidades” de Vellend (2010).
Meu interesse no tema deste ensaio se justifica pela minha trajetória acadêmica. Ao longo do meu desenvolvimento como estudante e pesquisadora na área da ecologia tenho me deparado, constantemente, com a falta de organização teórica sobre os efeitos antropogênicos nos sistemas naturais, quando não, com a completa ausência do reconhecimento de sua existência. Desde a minha graduação desenvolvi o interesse pela ecologia e por sua capacidade interdisciplinar e posso afirmar que o que me toma e tomou mais tempo durante a minha formação, e ainda hoje, é tentar descobrir como conectar os efeitos antropogênicos à teoria ecológica, tanto na teoria quanto na prática de meus projetos. Justamente por este motivo, ao me deparar com o texto de Vellend (2010), refleti sobre suas possíveis influências em minhas aspirações acadêmicas e percebi que esta proposta não me bastava.
Nesse ínterim, tenho me interessado, nos últimos anos, em compreender a relação entre os efeitos antropogênicos e a estrutura das comunidades de vertebrados silvestres. Em minha tese de doutorado proponho investigar os fatores que influenciam a estrutura das comunidades de mamíferos de médio e grande porte em paisagens alteradas, a fim de fomentar estratégias integradas de conservação ambiental e desenvolvimento local. Percebi durante a disciplina de ecologia de comunidades e com o artigo de Vellend (2010) que dois passos são essenciais para que eu possa desenvolver minha tese de doutorado de forma consistente e trazer contribuições significativas para a área: i) organizar de forma sistemática as conexões possíveis entre os efeitos antropogênicos e as comunidades de mamíferos em paisagens alteradas alicerçada por uma organização da teoria ecológica de comunidades; e ii) compreender, mesmo que superficialmente, como os efeitos antropogênicos afetam a seleção, a deriva, a especiação e a dispersão das comunidades de mamíferos em minha área de estudo.
*Optei por utilizar o termo “efeito antropogênico” por entender que a ação humana sobre a natureza não é, invariavelmente, negativa (como refletem conceitos como pressão e impacto), podendo ser positiva ou neutra.
Referências bibliográficas
Alberti, M., Marzluff, J. M., Shulenberger, E., Bradley, G., Ryan, C., & Zumbrunnen, C. (2003). Integrating humans into ecology: opportunities and challenges for studying urban ecosystems. BioScience, 53(12), 1169-1179.
Allendorf, F. W., R. F. Leary, P. Spruell, and J. K. Wenburg (2001). The problems with hybrids: setting conservation guidelines. Trends in Ecology & Evolution 16:613–622.
Begon, M., Townsend, C. R., & Harper, J. L. (2009). Ecologia: de indivíduos a ecossistemas. Artmed Editora. Bell G. 2008. Selection: The Mechanism of Evolution. Oxford (UK): Oxford University Press.
Castilla, J. C. (1999). Coastal marine communities: trends and perspectives from human-exclusion experiments. Trends in Ecology & Evolution, 14(7), 280-283.
Ciuti, S., Northrup, J. M., Muhly, T. B., Simi, S., Musiani, M., Pitt, J. A., & Boyce, M. S. (2012). Effects of humans on behaviour of wildlife exceed those of natural predators in a landscape of fear. PloS one, 7(11).
Egerton, F. N. (1983). The history of ecology: achievements and opportunities, part one. Journal of the History of Biology, 16(2), 259-310.
Helmus, M. R., Mahler, D. L., & Losos, J. B. (2014). Island biogeography of the Anthropocene. Nature, 513(7519), 543-546.
Holyoak M., Leibold M. A., Holt R. D. (2005). Metacommunities: Spatial Dynamics and Ecological Communities. Chicago (IL): University of Chicago Press.
Hubbell S. P. (2001). The Unified Neutral Theory of Biogeography and Biodiversity. Princeton (NJ): Princeton University Press.
Jax, K. (2011). History of Ecology. Encyclopedia of life sciences
Lawton J. H. (1999). Are there general laws in ecology? Oikos 84(2):177–192.
Leibold, M. A. (2009). Spatial and metacommunity dynamics in biodiversity. In: “The Princeton guide to ecology”, Simon A. Levin. Princeton University Press, p. 312-319.
Levin, S. A., Carpenter, S. R., Godfray, H. C. J., Kinzig, A. P., Loreau, M., Losos, J. B., … & Wilcove, D. S. (Eds.). (2009). The Princeton guide to ecology. Princeton University Press.
Likens, G. E., & Cronon, W. J. (2012). Humans as components of ecosystems: the ecology of subtle human effects and populated areas. M. J. McDonnell, & S. T. Pickett (Eds.). Springer Science & Business Media.
Loreau, M. (2009). Communities and Ecosystems. In: Levin, S. A. et al. (Ed.). The Princeton guide to ecology. Princeton University Press, 2009.
McPeek, M. A., & Gomulkiewicz, R. (2005). Assembling and Depleting Species Richness in Metacommunities. Metacommunities: spatial dynamics and ecological communities, 355.
Nosil, P. (2012). Ecological Speciation. Oxford: Oxford University Press. p. 280.
Ricklefs R. E. (1987). Community diversity: relative roles of local and regional processes. Science 235(4785):167– 171.
Ricklefs, R. E. (2010). A economia da natureza. In A economia da natureza. Guanabara Koogan.
Roughgarden J. (2009). Is there a general theory of community ecology? Biology and Philosophy 24(4):521–529.
Smith, B. D. (2007). The ultimate ecosystem engineers. SCIENCE-NEW YORK THEN WASHINGTON-, 315(5820), 1797.
Van Dyke, F. V. (2008). Conservation Biology: Foundations, Concepts, Applications, 2 ed. Springer. Verlag. p. 478.
Vellend, M., & Orrock, J. L. (2009). Ecological and genetic models of diversity. The theory of Island biogeography revisited. Princeton Univ. Press, Princeton, NJ, 439-462.
Vellend, M. (2010). Conceptual synthesis in community ecology. The Quarterly review of biology, 85(2), 183-206.
Vitousek, P. M. (1994). Beyond global warming: ecology and global change. Ecology, 75(7), 1861-1876.
Wu, J., & Hobbs, R. (2002). Key issues and research priorities in landscape ecology: an idiosyncratic synthesis. Landscape ecology, 17(4), 355-365.
Comunidades saturadas e invasão
Vinícius Leonardo Biffi
O nível de saturação de uma comunidade pode ser compreendido como o quanto os nichos ecológicos disponíveis naquela comunidade estão preenchidos. Uma comunidade saturada, portanto, teria todos os seus nichos preenchidos. O conceito de saturação está primeiramente relacionado aos conceitos de limite de similaridade e, consequentemente, de exclusão competitiva. Segundo essa visão, o nicho ecológico possui um tamanho mínimo, abaixo do qual a competição interespecífica deveria causar a extinção da espécie menos competitiva (Ricklefs, 1987). Assim, considerados os tamanhos mínimos dos nichos ecológicos, deveria haver um número máximo de espécies que a comunidade é capaz de suportar, o que ocorreria quando ela estivesse em equilíbrio.
Foram propostas diversas hipóteses para tentar medir esse número máximo de espécies, sendo que a maior parte consistia de explicações determinísticas sobre a formação de comunidades providas pelas interações interespecíficas dentro da própria comunidade (Connell, 1961; Lubchenco, 1978). Entretanto, a introdução da perspectiva regional promoveu a integração com as áreas de biogeografia, sistemática e paleontologia e retomou o debate sobre a saturação das comunidades, atrelando o conceito ao pool regional de espécies (Ricklefs, 1987). Sob essa perspectiva, uma comunidade pode ter espaço para outras espécies presentes no pool, que só não fazem parte daquela comunidade devido a alguma limitação de dispersão (Ricklefs, 1987; Tilman, 1997).
Uma maneira de demonstrar isso era plotar a riqueza de espécies na comunidade local contra a riqueza da comunidade regional, e obtendo um gráfico no qual a diversidade local aumentaria linearmente com a diversidade regional, como se as comunidades fossem obtidas por amostragem proporcional do pool regional (Loreau, 2000), enquanto que uma curva saturada seria típica de uma comunidade saturada. Entretanto, Loreau chama a atenção para o erro que era fazer essa correlação, justificando que a o padrão da curva seria um efeito da escala espacial utilizada, sendo assim uma demonstração da relação entre as diversidades α (dentro da comunidade local) e β (entre comunidades locais), e que portanto não indicaria a saturação da comunidade e a importância das interações interespecíficas. Como exemplo, Caley & Schluter (1997, apud Loreau, 2000) demonstraram que o simples aumento de tamanho da área analisada gerava um padrão de curva linear, sem que houvesse nenhuma interação entre espécies envolvida. Assim, Loreau identifica o balanço entre a heterogeneidade dentro e entre comunidades, junto à dispersão como força homogeneizadora, como possíveis geradores das variações de diversidade.
O nível de saturação de uma comunidade também é comumente relacionado ao seu grau de invasibilidade. Essa possibilidade chamou minha atenção pois meu atual trabalho de pesquisa está diretamente relacionado à chance de invasão de uma área por uma espécie considerada invasora - no caso, o cachorro doméstico, Canis lupus familiaris. É sugerido que comunidades saturadas não sustentariam a chegada de novas espécies, pois nessa situação todos os nichos estariam preenchidos (Ricklefs, 1987; Tilman, 1997; Wiens, 2011). Por consequência, comunidades mais diversas, e portanto mais saturadas, deveriam ser mais resistentes à invasão de espécies presentes no pool (Elton, 1958), hipótese que foi corroborada por Tilman (1997) e Shurin (2000). Porém, uma vez que a saturação da comunidade local só pode ocorrer com relação ao pool regional, como reforçado por Loreau (2000), o que deveria acontecer quando há a inclusão de espécies de fora daquele pool?
Vermeij (1991) sugeriu que em muitos dos intercâmbios de biota ocorridos durante o período Neogeno, não aconteceram extinções relacionadas às invasões, enquanto que foi frequente o aumento da riqueza de espécies em cada uma das regiões. Estudos com espécies invasoras mostraram que a competição não foi uma causa importante para a extinção de vertebrados em ilhas (Sax & Gaines, 2008), e que para plantas sua introdução chegou a aumentar a riqueza de espécies (Tilman, 1997; Sax & Gaines, 2008). Em uma revisão mais ampla, Wiens (2011) se utiliza de estudos filogenéticos e biogeográficos envolvendo ecomorfos de anuros arborícolas e de lagartos ápodes para defender que as comunidades não são necessariamente saturadas. Primeiramente, ele defende que comunidades locais podem ser invadidas por espécies que possuem características similares àquelas encontradas entre as espécies presentes no pool de espécies regional ou na comunidade. Em seguida, Wiens defende que a competição não impede a coocorrência de espécies com características similares mesmo em casos em que ela, dentre outras interações interespecíficas, parece ter um papel importante em direcionar a evolução de características relacionadas ao nicho. Estas seriam evidências de que as comunidades não se saturam com espécies, mesmo se considerada uma escala de tempo geológico. Entretanto, ainda que o autor apresente diversas características em comum dentro dos exemplos apresentados, não há evidências de que o nicho dos grupos estudados sejam completamente sobrepostos um ao outro, já que há diversas possibilidades de diferenciação, o que mantém a dúvida sobre a similaridade das espécies e, consequentemente, a saturação das comunidades. Um exemplo é a questão de qual a escala espacial considerada para definir a comunidade local (Loreau, 2000). Outro fator a ser considerado é a escala temporal em que ocorrem os eventos de invasão, já que os exemplos fornecidos por Wiens (2011) ocorrem na escala de dezenas de milhões de anos, inclusive com a ocorrência de irradiação dos clados estudados. Nos casos das invasões de causa antropogênica, o objeto de estudo é cada espécie invasora e a escala de tempo é de dezenas ou centenas de anos.
Ainda assim, a abertura das comunidades à invasão é reforçada por algumas teorias ecológicas que sugerem que uma maior similaridade ecológica entre um par de espécies pode dificultar a exclusão competitiva de alguma delas em uma escala de tempo finita (Leibold & McPeek, 2006; Scheffer & van Nes, 2006). Isso pode indicar que seja relativamente fácil para uma espécie invadir uma comunidade em que haja uma espécie nativa com características parecidas às do invasor (Wiens, 2011), quando seria natural pensar que isso levaria à extinção local de uma das duas espécies.
Essas proposições permitiram expandir minha maneira de enxergar o problema, que era completamente voltada para como os fatores abióticos poderiam contribuir para o sucesso da invasão, facilitando a expansão ou propagação de espécies invasoras e modificando o balanço das forças de interação entre espécies nativas e invasoras (e.g. Didham et al., 2007). Sobre isso, Wiens (2011) relembra a importância de fatores climáticos sobre o limite de distribuição de uma espécie, lembrando que análises em grande escala de espécies de vertebrados invasoras e suas distribuições latitudinais sugerem que espécies invasoras tendem a ter sucesso ao invadir regiões com climas similares à sua distribuição original. Porém, é um novo desafio pensar em como a semelhança com uma espécie nativa e a própria saturação da comunidade local poderiam influir sobre a chance de invasão.
Referências bibliográficas
Connell, J.H. 1961. The influence of interspecific competition and other factors on the distribution of the barnacle Chthamalus stellatus. Ecology 42(4): 710-723.
Didham, R.K., Tylianakis, J.M., Gemmell, N.J., Rand, T.A., Ewers, R.M. 2007. Interactive effects of habitat modification and species invasion on native species decline. TRENDS in Ecology and Evolution 22: 489-496.
Elton, C. S. 1958. The ecology of invasions by animals and plants. Methuen, London, England.
Leibold, M. A. & McPeek, M. A. 2006. Coexistence of the niche and neutral perspectives in community ecology. Ecology 87, 1399-1410.
Loreau, M. 2000. Are communities saturated? On the relationships between alpha, beta and gamma diversity. Ecology Letters 3: 73-76.
Lubchenco, J. 1978. Plant species diversity in a marine intertidal community: importance of herbivore food preference and algal competitive abilities. American Naturalist, 23-39.
Ricklefs, R. E. 1987. Community diversity: relative roles of local and regional processes. Science 235: 167-171.
Sax, D. F. & Gaines, S. D. 2008. Species invasions and extinction: the future of native biodiversity on islands. Proc. Natl Acad. Sci. USA 105, 114900-114907.
Scheffer, M. & van Nes, E. H. 2006. Self-organized similarity, the evolutionary emergence of groups of similar species. Proc. Natl Acad. Sci. USA 103, 6230-6235.
Shurin, J.B. 2000. Dispersal limitation, invasion resistance, and the structure of pond zooplankton communities. Ecology 81: 3074-3086.
Tilman, D. 1997. Community invasibility, recruitment limitation, and grassland biodiversity. Ecology, 78: 81-92.
Vermeij, G. J. 1991. When biotas meet: understanding biotic interchange. Science 253, 1099-1104.
Wiens J.J. 2011. The niche, biogeography and species interactions. Phil. Trans. R. Soc. B 366: 2336-2350.
Equilíbrio e não-equilíbrio na ecologia e nas ciências sociais : dos paralelos históricos e epistemológicos a novas abordagens
Ramiro Campelo Araújo Ribeiro
A ideia de equilíbrio e não-equilíbrio permeia, essencialmente, toda a história do pensamento ecológico e evolutivo. Em razão dessa enorme abrangência, ficam evidentes as ambiguidades em seu emprego e certas dificuldades na delimitação de uma definição precisa, que compreenda as várias formas tomadas ao longo de sua ampla recorrência. Contudo, independente das conotações historicamente específicas, em sua essência a noção de equilíbrio implica em constância no tempo; um sistema em estado de equilíbrio, portanto, responde a uma perturbação retornando ao estado inicial [1]. Essas concepções estão presentes nas bases filosóficas de diversas perspectivas e abordagens dessas ciências, fazendo parte de hipóteses formativas primordiais, figurando como pano de fundo de debates cruciais à transições de paradigmas, assim como no cerne de novos programas de pesquisa. A presença dessas premissas em muitos aspectos retóricos e teórico-metodológicos torna a análise desse conceito de grande relevância epistemológica e prática. As transformações paradigmáticas relacionadas com a permanência dessas ideias no centro dos debates em ecologia dizem respeito a importantes eventos de sua história, mas essas mudanças de ênfase - do equilíbrio estático, ao equilíbrio dinâmico e não-equilíbrio - nas abordagens refletem processos muito mais amplos do desenvolvimento da tradição intelectual ocidental, e evidenciam o fato de que seus antecedentes são tão antigos quanto a mesma.
A pervasividade dessas concepções na ecologia é notável, seja na forma de premissas intimamente articuladas aos modelos e teorias, seja na forma de corolários, ou como uma noção presente de forma mais difusa e menos formal nas perspectivas adotadas [2, 3]. Do nível menos inclusivo, autoecológico, da ecofisiologia de indivíduos - na forma de modelos de equilíbrio termodinâmico e ontogenético - ao nível mais inclusivo, macroecológico, das dinâmicas de comunidades e ecossistemas, diversos programas de pesquisa atuais incorporam os debates acerca dos conceitos de equilíbrio e não-equilíbrio. No gradiente de abordagens entre esses extremos, o conceito repercute nos modelos de ecologia de populações, na ideia da estabilidade numérica do equilíbrio demográfico, regulando tamanhos populacionais; no contexto das teorias de interações entre organismos, em um grande número de formas, como nos modelos de equilíbrio das dinâmicas predador-presa, planta-herbívoro, hospedeiro-parasitóide; no contexto da teoria genética de microevolução, no equilíbrio de Hardy-Weinberg, manifestando-se nos polimorfismos balanceados; no âmbito macroevolutivo, na dinâmica dos processos biogeográficos históricos.
A princípio seriamos inclinados a pensar que a introdução dessas noções deve-se à influência matemática durante o período formativo da ecologia moderna, sobretudo no programa de pesquisa da ecologia de populações, quando o sentido metafórico de equilíbrio foi fundido ao equilíbrio matemático, dando assim início aos debates acerca das questões de denso-dependência vs. denso-independência [4]. Contudo, a metáfora de equilíbrio não é meramente uma versão pré-teórica do equilíbrio matemático [4, 5] e essa discussão exemplifica o papel das metáforas no desenvolvimento de teorias científicas [4-7]. De fato, o ‘’equilíbrio’’ ou a ‘’economia da natureza’’ sintetiza a visão paradigmática de natureza como força benévola, evocando uma ideia metafísica de estabilidade determinística, ordenação e previsibilidade [4], e essas noções influenciaram tanto o desenvolvimento da ecologia como ciência quanto suas práticas atuais e a dimensão política de seu discurso.
Na ecologia, equilíbrio e não-equilíbrio são algumas das contrapartes modernas dessa noção metafórica de ‘’equilíbrio da natureza’’ proveniente da antiguidade clássica. Elemento fundamental dos mais importantes tratados filosóficos sobre as relações sociedade-ambiente da filosofia e história natural grega, nas obras de Hipócrates, Tucídides, Aristóteles e Plínio, noções de equilíbrio determinístico estão atreladas às proposições sobre relações entre diferenças ambientais e culturais, como clima e desenvolvimento político, produtividade da terra e estabilidade na organização social [8]. Assim, a premissa do equilíbrio chegou à ecologia moderna por meio de suas raízes na história natural [3,6] e resultou em uma série de tensões intelectuais ao longo do tempo.
No século XVIII, a ideia de equilíbrio aparece na obra do naturalista britânico Gilbert White (1720 - 1793) como um dos elementos fundamentais de sua ecologia árcade [9]. Na obra The Natural History and Antiquities of Selborne a ideia de equilíbrio entre homem e natureza incorpora os ideias idílicos que seriam contrapostos pela tradição antiarcadista [9] . Essa oposição toma uma forma um tanto ambivalente na obra de Lineu (1707-1778), e sua tentativa de reconciliação entre o ideal de amor pela natureza e a busca pelas ambições humanas por meio do racionalismo científico e crenças religiosas. Em seu influente tratado teológico The Oeconomy of Nature, um marco dos primórdios do pensamento ecológico, as interações geo-biológicas são representadas por meio de um retrato estático, como se todo movimento tomasse lugar em uma esfera confinada [9]. Assim como para os naturalistas gregos da antiguidade clássica, a ideia de equilíbrio é preponderante: há apenas um tipo de mudança na ordem natural, os padrões cíclicos que tornam a voltar ao seu ponto de partida. Na obra de Lineu, esse modelo é tido como um paradigma a partir do qual todos fenômenos ambientais tomam forma [9]. Na primeira metade do século XIX, essa noção toma um novo lugar na ecologia romântica de Henry David Thoreau (1817-1862) . A visão de natureza como um sistema de relações obrigatórias que não podem ser perturbadas sem que se destrua o equilíbrio perpétuo é herdada em parte do legado árcade de Gilbert White [9]. Em meados do século XIX, a ecologia Darwiniana marcou uma transição ideológica da ‘’ecologia romântica’’ para os ideias Victorianos de dominação da natureza. A ideia de equilibrio está contida como parte da influência Malthusiana na história natural desse século, e marca a primeira reação materialista ao essencialismo metafísico das filosofias gregas, no que Simberloff (1982)[10] chama de a revolução materialista e probabilística da ecologia. No século XX, contudo, as ideias de interdependência e holismo alcançariam novamente proeminência . A hipótese de que comunidades ecológicas tendem ao equilíbrio foi uma das hipóteses iniciais definidoras da ecologia [2], estando presente tanto nos primeiros modelos de ampla aceitação como nos polarizadores debates formativos iniciais.A metafísica grega reaparece como uma base filosófica do paradigma de ‘’superorganismo’’ e de ‘’sucessão determinística’’ de Clements [11,12],figura chave altamente influente na escola americana de ecologia vegetal que, embora contrapostos por Gleason, foi uma das ideias mais impactantes na ecologia da primeira metade do século XX [6,9,13].
Aspectos históricos das ideias correntes em ecologia revelam uma associação muito íntima com a ‘’paisagem intelectual’’ do pensamento ocidental e, dessa maneira, o dito ‘’pensamento ecológico’’ não diz respeito apenas ao âmbito disciplinar da área, incluindo importante conexões literárias, econômicas e filosóficas indosociáveis dos valores de época e de grande importância nos momentos formativos da ecologia moderna [9]. Essas marcantes transições de referenciais intelectuais, vistas nesse contexto mais amplo do desenvolvimento do pensamento ocidental, também revelam significantes transições na história das ciências sociais. Observar os paralelos entre essas transformações paradigmáticas é interessante não só para visualizar a evolução das ideias como também para evidenciar os empréstimos interdisciplinares ocorridos na gênese dessas ciências. Assim como o Darwinismo exerceu um profundo impacto nas ciências sociais, houve muitas importantes interações entre sociólogos e ecólogos do começo do século XX [2,9], visualizadas sobretudo na obra de Clements, que é particularmente instrutiva para exemplificar essas relações interdisciplinares. Nas suas influentes hipóteses, as teorias de organização de comunidades ecológicas é fortemente orientada por sociólogos do século XIX, como Henri Saint-Simon (1760-1825) e Auguste Comte (1798-1857), e, principalmente, pela filosofia evolucionista de Herbert Spencer (1820 - 1903). Assimilando as analogias orgânicas entre organização de sociedades humanas e o desenvolvimento de organismos [20], Clements elabora sua ideia de sucessão como um paralelo a ontogenia do organismo; concepções Spencerianas de progressismo e equilíbrio em movimento são incorporadas tanto como fundamentos filosóficos quanto no arcabouço de termos e conceitos, e essa visão ainda repercutiria no desenvolvimento inicial da Ecologia humana [2] e da antropologia social de Gluckman (1968) [14].
Do início dos anos 1960, com a hipótese de equilíbrio da teoria de biogeografia de ilhas de MacArthur e Wilson [15] ao final dos anos 1970, o pensamento ecológico finalmente passa por uma transição chave, e gradualmente a ênfase nos modelos matemáticos clássicos é abandonada e substituida pela ênfase no não-equilíbrio e indeterminação, com importantes consequências para a ecologia de comunidades, e as formulações sobre sua persistência e organização [3].
Nenhuma outra ciência social foi tão influenciada pela ecologia quanto a antropologia, e a transição entre perspectivas de equilíbrio para não-equilíbrio teve importantes paralelos no desenvolvimento da antropologia ecológica. Do período formativo às vertentes atuais, a maneira com que o ambiente é tido como um produto histórico e cultural de interações humano-natureza passa a ser gradualmente enfatizada, e a relação dicotômica entre cultura e natureza abandonada, substituída por uma visão de ambiente como um produto contingencial [16, 8]. Clássicos desse período inicial, como ‘’ Os Nuer’’ de Evans-Pritchard (1940) [17], retratam as sociedades estudadas evocando representações de estados ahistóricos de equilíbrio social. Nesses estágios iniciais, as teorias neo-evolucionistas da Ecologia Cultural de Julian Steward (1955)[18] e Marvin Harris (1966) [19] enxergavam mudança social como adaptações unilineares ao ambiente, tido como estático e determinístico [8,16]. As sociedades estudadas eram descritas de forma essencialmente apolítica, e consideradas como harmoniosas e estáticas. Essa visão ainda persistiria até os anos 60 e 70 por meio da adoção da abordagem ecossistêmica no funcionalismo ecológico de Rappaport (1967) [21], que ressaltava homeostase e equilíbrio dinâmico, evocando entidades cibernéticas para explicar a capacidade auto-regulatória da cultura nos sistemas estudados. A noção de sistemas socionaturais [22] substitui o conceito de ecossistema - que implica em homeostase, equilíbrio e delimitação - em favor de uma perspectiva que combina a tomada de decisão individual com os reflexos ambientais de forças sociais. Como uma reação ao determinismo ambiental, o programa da Ecologia Histórica passa a operar a partir de um entendimento dialético das relações entre populações humanas e o ambiente [23-25] . Embora tenha marcado uma grande transição entre abordagens sincrônicas e diacrônicas, assim como no discurso da ecologia da conservação, a antropologia ecológica viu, nos trabalhos em etnoecologia de Darrell Posey[26] , uma semelhante ênfase na noção de equilíbrio na militância política do ativismo indígena.
O final dos anos 1970 é o período mais representativo dessa grande mudança epistemológica, e o trabalho de May (1976)[27] pode ser visto como um marco por incorporar a crescente influência de ramos da matemática e física da teoria dos sistemas dinâmicos. O avanço no campo das teorias de não-equilíbrio, com as técnicas de análises não-lineares [28-30] dá ao estudo dos sistemas complexos uma posição proeminente em campos interdisciplinares, assim como um grande destaque para os debates entre teoria do caos e anti-caos dos anos 1980. Nesta década, a teoria de sistemas dinâmicos reconfigura o conceito de equilíbrio e não-equilíbrio desdobrando-o nos conceitos de estabilidade e instabilidade [33] e constituindo o ponto de partida para teorias de estados estáveis alternativos e transições críticas [32]. Nas perspectivas atuais, o impacto desses avanços deu um novo fôlego às análises das dinâmicas complexas envolvendo interações humano-ambiente [31, 32, 30]. Para a antropologia, a teoria dos sistemas complexos revelou uma instigante forma de visualizar propriedades emergentes em sistemas sociais e comportamentais [30], melhor representada pela vertente dos Sistemas Adaptativos Complexos [30]. O impacto dessas revoluções também foi incisivo na economia política que, igualmente, passou a relacionar atores sociais à dinâmicas globais de economias e sociedades no contexto da teoria dos jogos.
Às novas formas de abordar sistemas ecológicos e sociais subjaz a transição entre os modelos de causalidade linear, as dinâmicas não-lineares simples e as dinâmicas complexas. Em face da nova ideia de ‘’antropoceno’’, o desenvolvimento dessas novas formas de entender o papel do distúrbio antrópico na estruturação da paisagem e a compreensão de resiliência em sistemas socioecológicos [34] é de grande relevância.
Referências bibliográficas
1. Hastings, A. (2009). Biological chaos and complex dynamics. The Princeton Guide to Ecology.
2. Van der Valk, A. G. (2011). Origins and Development of Ecology. Philosophy of Ecology,11, 37-59. In Laplante, K. D., Brown, B., & Peacock, K. A. (Eds.) (2011). Philosophy of Ecology.
3. DeAngelis, D. L., and J. C. Waterhouse. 1987. Equilibrium and non equilibrium concepts in ecological models. Ecological Monographs 57: 1 21.
4. Cuddington, K. (2001). The “balance of nature” metaphor and equilibrium in population ecology. Biology and philosophy, 16(4), 463-479.
5. Kingsland, S.E.(1995). Modelling Nature: Episodes in the History of Population Ecology. The University of Chicago Press, Chicago.
6. Egerton, F. N. (1973). Changing concepts of the balance of nature. Quarterly review of biology, 322-350.
7. Maasen, S., Mendelsohn, E., & Weingart, P. (Eds.). (2001). Biology as society, society as biology: Metaphors (Vol. 18). Springer Science & Business Media.
8. Dove, M. R., & Carpenter, C. (2008). Environmental anthropology: A historical reader. Dove, Michael R. and Carol Carpenter, eds.
9. Worster, D. (1994). Nature's economy: a history of ecological ideas. Cambridge University Press.
10. Simberloff, D. (1982). A succession of paradigms in ecology: essentialism to materialism and probabilism (pp. 63-99). Springer Netherlands.
11. Clements, F.E. (1916). Plant Succession: an analysis of the development of vegetation. Washington: Carnegie Institute Publication.
12. Clements, F.E. (1936). Nature and structure of the clímax. Journal of Ecology 24: 252-284. 13. McIntosh, R. P. (1982). The background and some current problems of theoretical ecology. In Conceptual issues in ecology (pp. 1-61). Springer Netherlands.
14. Gluckman, M. (1968). The utility of the equilibrium model in the study of social change. American Anthropologist, 70(2), 219-237.
15. MacArthur, R.M. & Wilson, E.O. 1967. The theory of island biogeography. Princeton Univ. Press.
16. Biersack, A. (1999). Introduction: From the “new ecology” to the new ecologies. American Anthropologist, 101(1), 5-18.
17. Evans-Pritchard, E. E. (1940). The nuer (Vol. 940). Clarendon: Oxford.
18. Steward, J. H. (2006 [1955]). The concept and method of cultural ecology. The Environment in Anthropology: A Reader in Ecology, Culture and Sustainable Living, 5-9.
19. Harris, M. (1966). The Cultural Ecology of India's Sacred Cattle . Current Anthropology, 51-66.
20. Spencer, H. (1860). The social organism. Westminster review, 17, 51-68. 21. Rappaport, R. A. (1967). Pigs for the ancestors: ritual in the ecology of a New Guinea people. Waveland Press.
22. Bennett, J. W. (1993). Underlying Ideas: Ecological Transitions, Socionatural Systems, and Adaptive Behavior. John W. Bennett, Human Ecology as Human Behavior: Essays in Environmental and Developmental Anthropology. New Brunswick, NJ: Transaction, 3-22.
23. Balée, W. L. (2002). Advances in historical ecology. Columbia University Press.
24. Balée, W. (2006). The research program of historical ecology. Annu. Rev. Anthropol., 35, 75-98
25. Cleland, C. E., & Crumley, C. L. (1997). Historical Ecology: Cultural Knowledge and Changing Landscapes.
26. Posey, D., Frechione, J., Eddins, J., Da Silva, L., Myers, D., Case, D., & Macbeath, P. (1984). Ethnoecology as applied anthropology in Amazonian development. Human organization, 43(2), 95-107.
27. May, R. M. (1976). Simple mathematical models with very complicated dynamics. Nature, 261(5560), 459-467.
28. Ferriere, R. Fox, G.A. (1995) Chaos and Evolution. Tree 10:480-85
29. Levin, S. (1999).Fragile Dominion: Complexity and the Commons. Reading, MA: Perseus Books. 30. Lansing, J. S. (2003). Complex adaptive systems. Annual review of anthropology, 183-204.
31.Kohler, T. A., & Gumerman, G. (2000). Dynamics in human and primate societies. Santa Fe Institute Studies in the Sciences of Complexity (Oxford University Press, Oxford)
32. Scheffer, M. (2009). Critical transitions in nature and society. Princeton University Press.
33. McCann, K. S. (2000). The diversity–stability debate. Nature, 405(6783), 228-233.
34. Berkes, F., Colding, J., & Folke, C. (Eds.). (2008). Navigating social-ecological systems: building resilience for complexity and change. Cambridge University Press
Coexistência: Ecologia e Evolução
Luísa Novara Monclar Gonçalves
Dentro de Ecologia de Comunidades, a coexistência pode ser abordada de duas formas diferentes. Uma delas, identificada como coexistência instável, se refere à manutenção temporal da diversidade (riqueza e abundância relativa), ainda que a composição da comunidade se altere [1]. A segunda, chamada de coexistência estável, se refere à persistência de um conjunto específico de espécies em determinada área [2] e é caracterizada pela presença de feedbacks denso-dependentes negativos, em que a densidade das espécies tende a aumentar em níveis baixos e a reduzir em níveis altos [1]. Os mecanismos que geram estes feedbacks denso-dependentes devem aumentar os efeitos negativos intraespecíficos em relação aos interespecíficos, permitindo que cada espécie atue limitando mais a si própria do que a outras e então se perpetue no sistema sem excluir as demais [1]. Esses mecanismos, chamados de estabilizadores, compensam as diferenças de fitness entre as espécies, possibilitando que espécies com menor habilidade competitiva coexistam com melhores competidoras [3]. Os mecanismos estabilizadores incluem partição de recursos, predação dependente de frequência e outros componentes que diferenciam o nicho das espécies, por isso são comumente chamados de “diferenças de nicho” [4]. Outro tipo de mecanismo que facilita a coexistência são aqueles que atuam diretamente reduzindo as diferenças de fitness entre as espécies, chamados de equalizadores [1]. Esses mecanismos reduzem a intensidade de mecanismos estabilizadores necessária para promover a coexistência estável. Dessa forma, diz-se que a coexistência é regulada por um balanço entre desigualdade de fitness e diferenças de nicho [4], o que significa que a coexistência é possibilitada quando os efeitos estabilizadores das diferenças de nicho superam as diferenças na habilidade competitiva entre as espécies [3].
O conceito de coexistência desenvolvido acima constitui o componente central da Teoria Moderna da Coexistência [1, 4], que propõe um framework único para abarcar diferentes teorias que tentam explicar a coexistência de espécies. A definição e distinção matemática de mecanismos equalizadores e estabilizadores proposta é exaustiva, possibilitando que os modelos já desenvolvidos sejam interpretados sob esta nova ótica [1]. Em outras palavras, a Teoria Moderna da Coexistência traduz situações descritas por diferentes modelos para o contínuo de possibilidades de coexistência delimitado pelo equilíbrio entre diferença de fitness e diferença de nicho (Figura 1, legenda sobre a imagem). Ao relacionar diferenças de fitness pequenas ou nulas a uma condição neutra e mecanismos estabilizadores a diferenças de nicho, desconstrói-se a dicotomia entre a Teoria de Nicho e a Teoria Neutra, tratando-as como descritoras de diferentes cenários do mesmo contínuo. Assim, comunidades estruturadas predominantemente por processos neutros seriam aquelas em que as espécies apresentam fitness equivalentes e há pouca ou nenhuma atuação de mecanismos estabilizadores, enquanto comunidades estruturadas principalmente por processos de nicho seriam aquelas em que as espécies apresentam fitness diferentes que são contrabalanceados por fortes mecanismos estabilizadores [4]. A síntese da teoria neutra com a teoria de nicho clássica oferecida pela Teoria Moderna da Coexistência permite formularmos a pergunta: em que medida a diversidade que observamos nas comunidades naturais resultam de mecanismos de estabilização fortes (nichos) superando grandes diferenças de fitness contra estabilização fraca operando em espécies de fitness semelhante (neutralidade) [4]?
A resposta a essa pergunta pode ser obtida por meio da parametrização experimental ou observacional de modelos teóricos que permitem quantificar os mecanismos estabilizadores e as diferenças de fitness, método que também foi desenvolvido por expoentes da Teoria Moderna da Coexistência [3, 4, 5]. Considerando que mecanismos estabilizadores fazem com que efeitos intraespecíficos sejam mais negativos do que efeitos interespecíficos, um teste simples da presença de mecanismos estabilizadores é comparar efeitos intra e interespecíficos em taxas vitais como germinação, crescimento e sobrevivência de espécies que coocorrem [3, 4, 5]. Para isso, pode-se medir a relação entre as taxas vitais de cada espécie e sua frequência relativa na comunidade, que deve ser negativa quando mecanismos estabilizadores estão operando. Já para quantificar as diferenças de fitness - inequalidades nas capacidades competitivas persistentes na ausência de qualquer mecanismo estabilizador - pode-se utilizar como proxy a taxa de crescimento da população de cada espécie quando os efeitos intraespecíficos e interespecíficos são equivalentes [3, 4, 5]. Para isso, é necessário parametrizar modelos teóricos que calculam a taxa de crescimento das populações com as taxas vitais medidas empiricamente e ajustar os parâmetros correspondentes aos efeitos intraespecíficos para que sejam equivalentes aos parâmetros correspondentes aos efeitos interespecíficos. Por fim, pode-se quantificar a importância dos mecanismos estabilizadores na manutenção da coexistência ao comparar, por meio de experimentos ou simulações, o número e a taxa de exclusões competitivas que ocorrem na presença e na ausência dos mecanismos estabilizadores [3, 4, 5]. Neste contexto, é possível perceber que a maneira como a Teoria Moderna da Coexistência foi modelada estimula a integração entre teoria, observação e experimentação, o que lhe confere coerência [6] e possibilita a geração de hipóteses sólidas que direcionam os pesquisadores à fronteira do conhecimento [7].
Ao permitir a formulação de hipóteses testáveis e predições quantificáveis acerca da coexistência de espécies, a Teoria Moderna da Coexistência confrontou diversas hipóteses verbais ou intuitivas bastante difundidas dentro de Ecologia de Comunidades até então. Um pressuposto chave para isso foi a constatação de que as diferenças entre as espécies podem apresentar naturezas e efeitos distintos (aquelas relacionadas ao fitness, que dificultam a coexistência, e relacionadas ao nicho, que promovem a coexistência) [8]. Uma das predições confrontada bastante difundida é a de que comunidades estruturadas por competição seriam filogeneticamente dispersas, já que espécies mais aparentadas competiriam mais intensamente entre si, e comunidades estruturadas por filtragem ambiental seriam filogeneticamente agrupadas, já que espécies mais aparentadas compartilhariam do atributo que lhes permitiria sobreviver em determinado local. Entretanto, considerando que o atributo importante para o sucesso das espécies pode estar relacionado à sua habilidade competitiva e não a seu nicho, espécies distantes filogeneticamente daquelas que apresentam tal atributo teriam menor fitness e seriam excluídas competitivamente, gerando comunidades estruturadas por competição, mas com um padrão de agrupamento filogenético [9, 10]. Assim, com o advento da Teoria Moderna da Coexistência, os estudos que visam inferir os processos que governam a montagem das comunidades com base em sua estrutura filogenética devem ser repensados [8]. A abordagem mecanística da Teoria Moderna da Coexistência integrada ao estudo dos padrões emergentes de dispersão de atributos e de dispersão filogenética, além de confrontar antigas predições, permite que sejam feitas generalizações sobre a importância dos atributos para a coexistência das espécies em diversas comunidades, sustentando predições relacionadas às mudanças na biodiversidade em curso atualmente [11]. O poder de generalização conferido por abordagens mecanísticas já havia sido enfatizado por Werner [6].
A Teoria Moderna da Coexistência pode então ser utilizada para pensar diversos processos e fatores pervasivos na natureza como potenciais mecanismos de manutenção da coexistência. O efeito na coexistência de alguns desses fatores, como trade-offs relacionados à estratégia de vida e à ocorrência de distúrbios, está sujeito a constantes reconsiderações [12, 13, 14, 15,16], potencialmente em função da ausência de um framework que identifique e defina com precisão os mecanismos que o regulam. Os trade-offs entre fecundidade e longevidade podem ser pensados como mecanismos que reduzem a diferença potencial de fitness entre espécies com estratégias de vida distintas, identificando-se como mecanismos equalizadores [1, 4]. O trade-off atuaria prevenindo o surgimento evolutivo de “demônios de Darwin” [17], que neste caso seriam espécies com estratégias de vida de longevidade e fecundidade elevadas. Trade-offs equalizadores podem promover a coexistência ao reduzir a força de processos estabilizadores necessária para superar as diferenças de fitness [4]. Já a ocorrência de distúrbios abióticos afeta todas as espécies de forma proporcional, e dessa forma não há promoção da coexistência, uma vez que os fitness de todas as espécies seriam reduzidos sem alterar a diferença entre eles [16]. Entretanto, quando consideramos o trade-off entre longevidade e fecundidade simultaneamente, é possível que a ocorrência de distúrbios atue como um mecanismo equalizador. Isso ocorreria quando as piores competidoras fossem aquelas com maior fecundidade (em detrimento de longevidade) e assim conseguissem ocupar os espaços abertos pelos eventos de distúrbio com seus propágulos. Neste caso, o fitness dessas espécies aumentaria, reduzindo a diferença em relação às melhores competidoras. Dessa forma, o trade-off atuaria como um mecanismo de manutenção de coexistência que seria potencializado pelo distúrbio.
Os processos que atuam como mecanismos de manutenção da diversidade e da coexistência, seja de forma equalizadora ou estabilizadora, podem ser pensados ainda como mecanismos geradores de diversidade e promotores de coexistência quando ampliamos o recorte de coexistência local e ecológica dado pela Teoria Moderna. Ao tratarmos as espécies como populações que evoluem e não como entidades imutáveis, podemos estudar o efeito de alguns processos na coexistência a longo prazo de diferentes estratégias de vida não pela via ecológica [1] mas pela via evolutiva [18, 19, 20]. A existência de um trade-off entre longevidade e fecundidade, por exemplo, possibilita a evolução de espécies com estratégias distintas, já que estas teriam fitness equivalentes. Na ausência do trade-off, apenas um tipo de estratégia de vida seria favorecido. A adaptação a um tipo específico de estratégia ou a possibilidade do surgimento evolutivo de mais de uma devem ser moduladas por meio da pressão exercida pelo distúrbio. Novamente, o trade-off apresenta um papel essencial para a diversidade e o distúrbio pode potencializá-lo, mas aqui falamos de geração no lugar de manutenção da coexistência. As vias ecológica e evolutiva podem diferir nas escalas temporais e de organização em que atuam e de intensidade do processo pelas quais são influenciadas [18, 20]. Em geral, o efeito de processos em dinâmicas ecológicas apresenta escala temporal menor e se dá na abundância relativa de populações dentro da comunidade, enquanto que o efeito dos mesmos processos em dinâmicas evolutivas apresenta escala temporal maior e se dá na frequência relativa de genótipos ou fenótipos dentro das populações. Ainda, diferentes intensidades dos processos podem influenciar mais as vias ecológicas ou as evolutivas, fazendo com que haja alguns intervalos em que a estrutura e a montagem da comunidade é influenciada mais pela dinâmica evolutiva e outros mais pela dinâmica ecológica (Figura 2, legenda sobre a imagem).
Ao considerar tanto a dinâmica ecológica quanto a dinâmica evolutiva, é possível perceber as maneiras distintas em que os mesmos processos podem atuar quando tratamos de diversidade e coexistência [18, 20]. A importância de se considerar ambas as dinâmicas é evidenciada quando seus efeitos na diversidade são opostos ou interativos. Quando há sobreposição ainda que parcial das escalas de atuação das dinâmicas ecológica e evolutiva, ocorrem interações que alteram os padrões de diversidade e coexistência previstos sob a análise das dinâmicas em separado [18]. Isso significa dizer que mudanças ecológicas podem gerar mudanças evolutivas, como na emergência de espécies com fitness semelhantes a partir de interações competitivas [21, 22, 23], e mudanças evolutivas podem gerar mudanças ecológicas, como na contingência do sinal das interações bióticas em relação à trajetória evolutiva das espécies [24]. É possível pensar, por exemplo, que a constante adaptação ao cenário seletivo presente leva ao surgimento de espécies com fitness cada vez maiores [25], entre as quais ocorre uma dinâmica ecológica neutra, mas que estabelecem interações não neutras com espécies mais antigas [26]. A Teoria Moderna da Coexistência, se ampliar seu escopo de manutenção para geração de diversidade, pode ajudar a identificar o efeito da relação entre as dinâmicas ecológicas e evolutivas para a coexistência, assim como estudos evolutivos se aprofundarão no entendimento de processos que geram a diversidade ao incluírem o contexto de comunidades dado pela Teoria Moderna. O estreitamento entre Ecologia e Evolução se faz necessário ao constatarmos que os mesmos processos que geram mudanças ecológicas geram também mudanças evolutivas e que há interação entre as dinâmicas [18, 19]. Além disso, essa aproximação é esperada em um contexto em que esses processos que atuam na diversidade das comunidades ganham destaque em relação aos padrões [2].
Referências Bibliográficas
[1] Chesson P. (2000). Mechanisms of maintenance of species diversity. Annual Review of Ecology and Systematics, 31: 343–366.
[2] Vellend, M. (2010). Conceptual synthesis in community ecology. Q. Rev. Biol., 85: 183–206.
[3] Levine, J.M. & HilleRisLambers, J. (2009). The importance of niches for the maintenance of species diversity. Nature, 461: 254–257.
[4] Adler, P.B.; HilleRisLambers, J. & Levine J.M. (2007). A niche for neutrality. Ecology Letters, 10:95–104.
[5] Adler, P.B.; Ellner, S.P. & Levine, J.M. (2010). Coexistence of perennial plants: an embarrassment of niches. Ecology Letters, 13:1019-29.
[6] Werner, E. E. (1998). Ecological experiments and a research program in community ecology. Experimental ecology: issues and perspectives, 3-26.
[7] Root-Bernstein, R. (2008). I don't know. In: de Vitek, W., & Jackson, W. eds. The virtues of ignorance: complexity, sustainability, and the limits of knowledge.
[8] HilleRisLambers, J.; Adler, P.B.; Harpole, W.S.; Levine, J.M. & Mayfield, M.M. (2012). Rethinking community assembly through the lens of coexistence theory. Annu. Rev. Ecol. Syst., 43: 227–248.
[9] Mayfield, M.M. & Levine, J.M. (2010). Opposing effects of competitive exclusion on the phylogenetic structure of communities. Ecology Letters, 13: 1085–1093.
[10] Godoy, O.; Kraft, N.J. & Levine, J.M. (2014). Phylogenetic relatedness and the determinants of competitive outcomes. Ecology Letters, 17(7): 836-844.
[11] Adler, P.B.; Fajardo, A.; Kleinhesselink, A.R. & Kraft, N. J. (2013). Trait‐based tests of coexistence mechanisms. Ecology Letters, 16(10): 1294-1306.
[12] Connell, J.H. (1978) Diversity in Tropical Rain Forests and Coral Reefs: High diversity of trees and corals is maintained. Science, 199: 1302-1310.
[13] Tilman, D. (1994). Competition and biodiversity in spatially structured habitats. Ecology, 75(1): 2–16.
[14] Yu, D.W. & Wilson, H.B. (2001). The competition-colonization trade-off is dead: long live the competition-colonization trade-off. Am. Nat., 158: 49–63.
[15] Calcagno, V.; Mouquet, N.; Jarne, P. & David, P. (2006). Coexistence in a metacommunity: the competition–colonization trade-off is not dead. Ecology Letters, 9: 897–907.
[16] Fox, J.W. (2013) The intermediate disturbance hypothesis should be abandoned. Trends in Ecology & Evolution. 28: 86–92.
[17] Bonsall, M.B.; Jansen, V.A.A. & Hassell, M.P. (2004). Life history trade-offs assemble ecological guilds. Science, 306: 111–114.
[18] Urban, M.C.; Leibold, M.A.; Amarasekare, P.; De Meester, L.; Gomulkiewicz, R.; Hochberg, M.E.; … & Pantel, J.H. (2008). The evolutionary ecology of metacommunities. Trends in ecology & evolution, 23(6): 311-317.
[19] Venail, P.A.; MacLean, R.C.; Bouvier, T.; Brockhurst, M.A.; Hochberg, M.E. & Mouquet, N. (2008). Diversity and productivity peak at intermediate dispersal rate in evolving metacommunities. Nature, 452(7184): 210-214.
[20] Hubert, N.; Calcagno, V.; Etienne, R. S. & Mouquet, N. (2015). Metacommunity speciation models and their implications for diversification theory. Ecology letters, 18(8): 864-881.
[21] Holt, R.D. (2006) Emergent neutrality. Trends Ecol. Evol. 21: 531–533.
[22] Hubbell, S.P. (2006) Neutral theory and the evolution of ecological equivalence. Ecology, 87: 1387–1398.
[23] Scheffer, M.; van Nes, E. (2006) Self-organized similarity, the evolutionary emergence of groups of similar species. Proc. Natl Acad. Sci., 103: 6230–6235.
[24] Thompson, J.N. (2005) The Geographic Mosaic of Coevolution, University of Chicago Press.
[25] Van Valen, L. (1973). A new evolutionary law Evol. Theory, 30: 1–30.
[26] Rosindell, J.; Harmon, L.J. & Etienne, R. S. (2015). Unifying ecology and macroevolution with individual-based theory. Ecology letters, 18(5): 472-482.
Potenciais consequências de impactos não letais de cães domésticos sobre comunidades nativas
Caio Filipe da Motta Lima
Há tempos é reconhecido que os efeitos de um predador sob a estrutura de uma comunidade podem se estender muito além das populações das espécies que ele consome, podendo afetar indiretamente populações de outros predadores, outras espécies de presas e seus recursos. Tradicionalmente ecólogos tem descrito estes efeitos indiretos como sendo decorrentes quase exclusivamente do impacto dos predadores sobre a densidade de presas. Estes efeitos são classificados como Interações Indiretas Mediadas por Densidade (IIMD) e representam as consequências dos efeitos letais dos predadores. No entanto, a mortalidade direta é apenas uma das muitas formas através das quais os predadores governam a organização da comunidade. As presas podem responder de forma adaptativa para evitar a predação, por exemplo, mudando habitats, taxas de forrageamento, ou até mesmo atributos morfológicos. Estas respostas podem reduzir a predação, mas ao custo de prejudicar, por exemplo, a aquisição de recursos e habilidade competitiva, levando a impactos para população da presa e também à interferências indiretas em outras populações da comunidade dentro da cadeia trófica. Estes tipos de interações indiretas tem sido denominados Interações Indiretas Mediadas por Atributos (IIMA) e representam as consequências dos efeitos não letais dos predadores. Estas interações tem recebido maior atenção dos ecólogos recentemente e se destaca como uma área muito ativa atualmente na ecologia de comunidades. (Holt 2009; Schmitz, et al. 2004). Peacor & Werner (2001) demostraram que os efeitos não letais de um predador podem contribuir substancialmente para os efeitos de teia indiretos através da evidência de que respostas fenotípicas da presa tem um papel muito grande na determinação das consequências das interações entre as espécies. Efeitos não letais ocorrem independentemente dos efeitos letais, portanto as IIMA surgem através de presas potenciais que permanecem no sistema, enquanto as IIMD surgem devido à remoção de presas do sistema. A taxa de forrageamento devido à presença do predador (efeito não letal) é imediata, afeta a população inteira, e ocorre durante todo o tempo de vida de uma população. Portanto, o efeito cumulativo de um predador sobre o tempo de vida de um grupo de presas pode ser muito significante. Já os efeitos letais de redução de densidade ocorrem gradualmente ao longo do tempo e são transmitidos apenas na proporção da remoção dos indivíduos e não na população inteira de presas.
Plasticidade Fenotípica
Pode-se questionar portanto, se muitos dos efeitos indiretos que são tradicionalmente atribuídos à ingestão de presas e consequente redução de suas densidades, podem na realidade ser devido aos predadores induzirem mudanças nos atributos das presas. Mas para elaboração desta hipótese é importante que se compreenda de que forma podem ocorrer estas alterações de atributos. E para isto podemos recorrer ao conceito de plasticidade fenotípica, que pode ser definida como a produção de múltiplos fenótipos a partir de um único genótipo, dependendo das condições ambientais. (Miner, et al. 2005). Estas respostas plásticas incluem mudanças no comportamento, fisiologia, morfologia, crescimento, história de vida e demografia, e podem ser expressadas durante o tempo de vida de um único indivíduo ou através de gerações. Há uma vasta literatura documentando padrões de expressão de plasticidade e interações entre genótipos e o ambiente, testando se as respostas são adaptativas, e modelando como a evolução afeta a plasticidade. No entanto, é muito pouco compreendido o impacto ecológico da plasticidade fenotípica. Como a plasticidade pode alterar uma variedade de interações diretas e indiretas entre os indivíduos e o ambiente que os cerca, pode portanto afetar muitos processos ecológicos, como dinâmicas de populações e comunidades, e aspectos funcionais de comunidades e ecossistemas (Miner, et al. 2005).
Tais respostas plásticas são frequentemente induzidas por pistas ambientais, no entanto, estas podem ficar potencialmente menos confiáveis e afetar negativamente as populações, por exemplo como resultado de efeitos antropogênicos. Quando isso ocorre denomina-se armadilha evolucionária. Embora armadilhas evolucionárias possam surgir sempre que um organismo que é plástico utiliza uma pista que se torna menos confiável, efeitos negativos são propensos a ser maiores quando pistas para plasticidades neutras ou adaptativas são alteradas, pois o que eram respostas benéficas ou neutras passam a ser respostas deletérias. Supondo que muitas espécies tem plasticidades adaptativas em relação a outras espécies, espécies invasoras podem ser uma causa comum e importante de armadilhas evolucionárias (Miner, et al. 2005).
Paisagem do Medo
Embora diversos estudos apontem que as IIMA são importantes para modulação da estrutura e dinâmica da comunidade, na natureza é muito difícil distinguir e quantificar os efeitos específicos de IIMA e IIMD. Dentro deste contexto é proposta a hipótese de que fatores como o habitat, o uso do espaço, e as estratégias de caça podem determinar se os efeitos do comportamento anti-predador da presa persiste ou é atenuado no nível da comunidade, ou seja, se IIMA ou IIMD dominam (Figura 1). Diferentes predadores apenas criam diferentes padrões de interação baseados em seu modo de caça e domínio do espaço. Estes diferentes padrões determinam se IIMA ou IIMD aparecem nos níveis de população e comunidade (Schmitz, et al. 2004). Uma concepção promissora neste cenário é olhar para sistemas ecológicos como “paisagens de medo” (landscape of fear). Supondo que é comum a heterogeneidade de habitats e terrenos ao longo da paisagem e que predadores específicos não são adaptados para ser habilidosos em todos os tipos de paisagens, é fácil conceber um sistema onde a letalidade do predador e consequentemente o risco de predação, varia com mudanças espaciais no tipo de habitat ou estrutura. Esta é, portanto, a “paisagem de medo”, uma paisagem tridimensional a qual os picos e vales são definidos pelo nível do risco de predação relacionado com mudanças no habitat quando estas afetam a letalidade do predador (Figura 2). Quantificando a “paisagem de medo” para um sistema predador-presa específico, poderemos realizar predições mais precisas quanto aos resultados da relação predador-presa. (Laundré et al. 2010).
 Figura 1 - Natureza hipotética de cascata trófica emergente em casos envolvendo diferentes respostas comportamentais de presas a predadores com diferentes modos de caça e domínios de habitat. S & P, A e S & W representam as seguintes estratégias de caça sentar-e-perseguir, ativo e sentar-e-esperar, respectivamente. Espécies com um domínio de habitat estreito selecionam apenas parte de todo o habitat disponível. Espécies com um domínio habitat amplo utilizam toda a gama de habitat. TMII representa sigla em inglês para Interação Indireta Mediada por Atributo e DMII para Interação Indireta Mediada por Densidade. (Schmitz et al. 2004)
Figura 1 - Natureza hipotética de cascata trófica emergente em casos envolvendo diferentes respostas comportamentais de presas a predadores com diferentes modos de caça e domínios de habitat. S & P, A e S & W representam as seguintes estratégias de caça sentar-e-perseguir, ativo e sentar-e-esperar, respectivamente. Espécies com um domínio de habitat estreito selecionam apenas parte de todo o habitat disponível. Espécies com um domínio habitat amplo utilizam toda a gama de habitat. TMII representa sigla em inglês para Interação Indireta Mediada por Atributo e DMII para Interação Indireta Mediada por Densidade. (Schmitz et al. 2004)
 Figura 2 - Representação visual da paisagem do medo, onde o eixo X e Y representam as coordenadas físicas de uma área e podem ser em metros ou quilômetros, dependendo da escala. O eixo z é o nível de risco de predação, como medido pelos índices de medo, por exemplo, vigilância, dando-se densidades (Guds), etc. (Laundré et al. 2010).
Figura 2 - Representação visual da paisagem do medo, onde o eixo X e Y representam as coordenadas físicas de uma área e podem ser em metros ou quilômetros, dependendo da escala. O eixo z é o nível de risco de predação, como medido pelos índices de medo, por exemplo, vigilância, dando-se densidades (Guds), etc. (Laundré et al. 2010).
Potenciais efeitos não letais de cães domésticos
Tendo em vista o panorama apresentado, o objetivo do presente ensaio é propor a utilização de tais conceitos ecológicos como potenciais ferramentas para uma melhor compreensão do impacto de cães domésticos (Canis lúpus familiaris) em comunidades de animais silvestres em áreas rurais. Em países em desenvolvimento, cães mantidos soltos e cães ferais em áreas rurais representam um problema cada dia mais importante, uma vez que as populações humanas estão expandindo as fronteiras em direção de áreas naturais e de produção rural (Vanak & Gompper, 2009; Wittemyer, et al., 2008; Young, et al., 2011). Estudos recentes demonstraram que cães em áreas rurais podem representar ameaça aos animais silvestres, e é amplamente relatado em literatura que estes impactos poderiam se dar através de predação, competição ou como fonte de doenças infecciosas (K. a Alexander & McNutt, 2010; Hughes & Macdonald, 2013; Sepúlveda, et al., 2014; Vanak & Gompper, 2009; Young et al., 2011). No entanto, após a compreensão do potencial das IIMA em modular a estrutura e a dinâmica de comunidades, proponho que este conceito seja aplicado também no estudo das interações dos cães domésticos dentro de comunidades ecológicas. Levando em conta o potencial de plasticidade fenotípica de possíveis presas e competidores de cães domésticos e tendo em vista comportamentos dos cães domésticos como, por exemplo, proteção do território, predação, caça recreativa, e formação de grupos, pode-se imaginar que a presença destes animais em uma comunidade poderia levar a impactos que vão muito além do efeito sobre a densidade de populações específicas através de predação ou transmissão de parasitas. Minha hipótese é de que a introdução destes animais em comunidades ecológicas podem alterar atributos (plasticidade) em diversas populações de animais silvestres, podendo levar à muitas das consequências descritas anteriormente. A introdução destes animais, portanto, poderia criar um novo padrão de “paisagem de medo” dentro da comunidade. Estas adaptações poderiam levar a alterações comportamentais como área e taxa de forrageiro e até mesmo a plasticidades fisiológicas como estresse crônico e consequentes alterações em taxas reprodutivas. Estas mudanças nas populações afetadas poderiam desencadear diversas IIMA que, como destacado previamente, podem levar à mudanças significativas na estrutura e dinâmica das comunidades.
A influência dos cães domésticos pode se estender para diversos grupos de animais silvestres, mas ressalto uma comunidade específica a qual constitui meu objeto de pesquisa: a comunidade de carnívoros silvestres em áreas rurais antropizadas. Neste caso, as interações entre os cães e os diferentes carnívoros, dependendo da espécie e do contexto em questão, poderiam ser classificadas como predação intraguilda (considerando a predação de carnívoros silvestres por cães) ou como competição por interferência (considerando alimentação e principalmente território). No entanto, para o ponto destacado neste ensaio, esta diferenciação não se faz necessária. Independente da interação ecológica específica, os efeitos não letais dos cães domésticos poderiam ter um impacto significativo na comunidade de carnívoros silvestres através de mudanças em seus atributos, podendo levar inclusive à alterações nas interações pré estabelecidas entre os carnívoros silvestres.
Ao se estudar cães domésticos, no entanto, alguns outros fatores devem ser incorporados na análise dos dados buscando uma visão ampla das interações ecológicas. Primeiramente, deve-se considerar questões socioculturais, pois o padrão de uso de espaço dos cães está diretamente relacionado com a localização das comunidades humanas, a forma de criação destes e o seu papel na família. Tendo isto em mente podemos levantar algumas questões importantes. Em geral as plasticidades fenotípicas das presas levam à uma redução na taxa de predação, que em contrapartida reduz a densidade de predadores, mantendo um equilíbrio da relação predador-presa (Miner et al. 2005). Mas será que este padrão se aplica a cães domésticos? Como os cães não coevoluiram com as espécies silvestres, será que estas desenvolvem adaptações à presença dos cães ou esta poderia representar uma armadilha evolutiva para determinadas espécies? Caso haja o desenvolvimento da plasticidade fenotípica das presas, será que haveria uma redução na densidade de cães? Caso os humanos representem o fator que determina a densidade de cães na comunidade, qual seria o impacto da falta deste feedback negativo para a populações de presas? São inúmeras as perguntas sobre o papel de cães domésticos em comunidades de animais silvestres, mas após me aprofundar nos conceitos apresentados neste ensaio, acredito que as respostas para muitas destas perguntas passam por um melhor entendimento de fatores ligados à plasticidade fenotípica e “paisagens de medo”, assim poderemos compreender os diferentes efeitos de IIMA e IIMD e consequentemente ampliar o conhecimento do impacto dos cães para o nível de comunidades.
Referências bibliográficas
Alexander, K. a, & McNutt, J. W. (2010). Human behavior influences infectious disease emergence at the human–animal interface. Frontiers in Ecology and the Environment, 8(10), 522–526.
Holt, R.D. (2009). Predation and community organization. In: Levin, S.A. The Princeton guide of ecology. Princeton university press, Princeton. 274-281.
Hughes, J., & Macdonald, D. W. (2013). A review of the interactions between free-roaming domestic dogs and wildlife. Biological Conservation, 157, 341–351.
Laundré, J.W., Hernández, L., & Ripple, W.J. (2010). The landscape of fear: ecological implications of being afraid. The Open Ecology Journal, 3, 1-7.
Miner, B.G., Sultan, S.E., Morgan, S.G., Padilla, D.K. & Relyea, R.A. (2005). Ecological consequences of phenotypic plasticity. Trends in Ecology and Evolution, 20, 685-692.
Peacor, S.D. & Werner, E.E. (2001). The contribution of trait-mediated indirect effects to the net effects of a predator. PNAS, 98, 7, 3904-3908.
Schmitz, O.J., Krivan, V., & Ovadia, O. (2004). Trophic cascades: the primacy of trait-mediated indirect interactions. Ecology Letters, 7, 153-163.
Sepúlveda, M., Singer, R. S., Silva-Rodríguez, E., Stowhas, P., & Pelican, K. (2014). Domestic dogs in rural communities around protected areas: conservation problem or conflict solution? PloS One, 9(1), e86152.
Vanak, A. T., & Gompper, M. E. (2009). Dogs Canis familiaris as carnivores: their role and function in intraguild competition. Mammal Review, 39(4), 265–283.
Wittemyer, G., Elsen, P., Bean, W. T., Burton, a C. O., & Brashares, J. S. (2008). Accelerated human population growth at protected area edges. Science (New York, N.Y.), 321(5885), 123–6.
Young, J. K., Olson, K. a., Reading, R. P., Amgalanbaatar, S., & Berger, J. (2011). Is Wildlife Going to the Dogs? Impacts of Feral and Free-roaming Dogs on Wildlife Populations. BioScience, 61(2), 125–132.


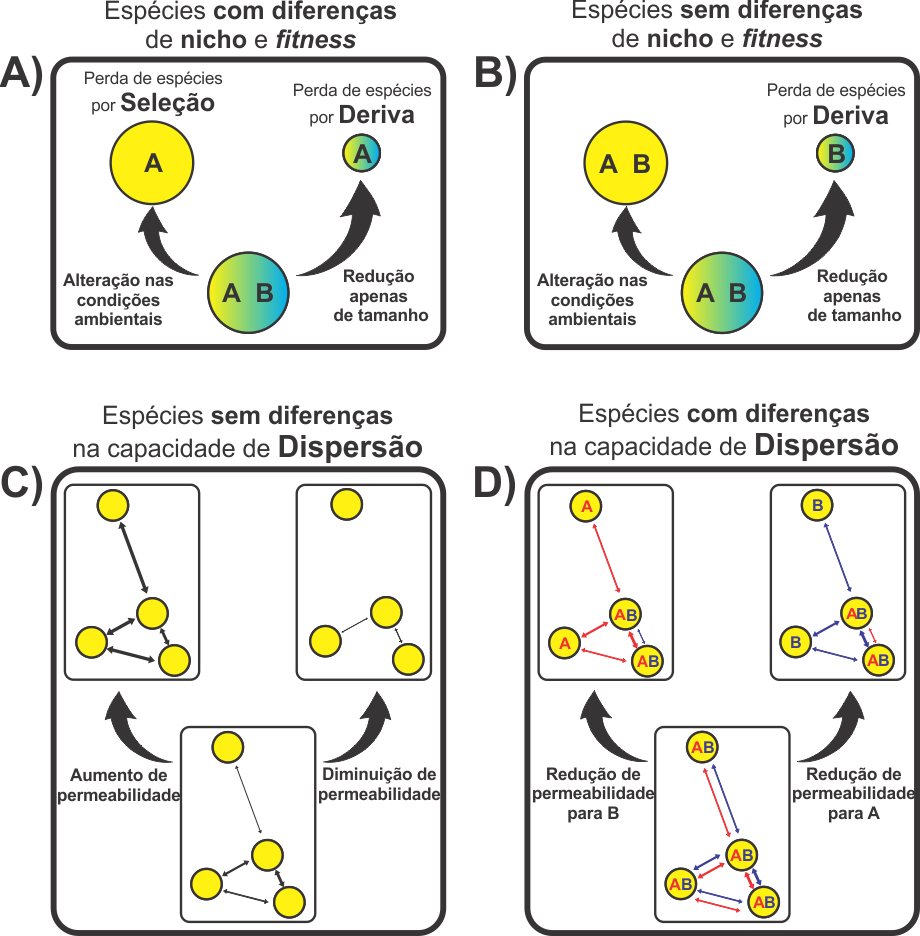
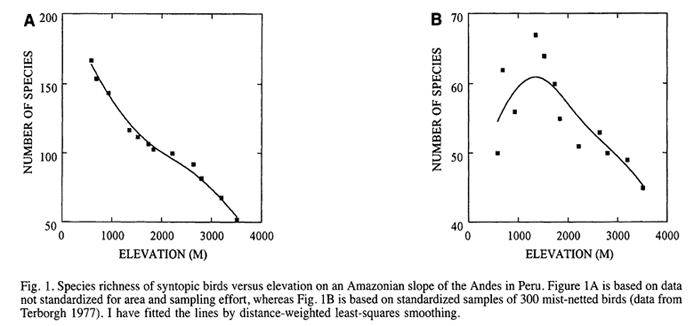
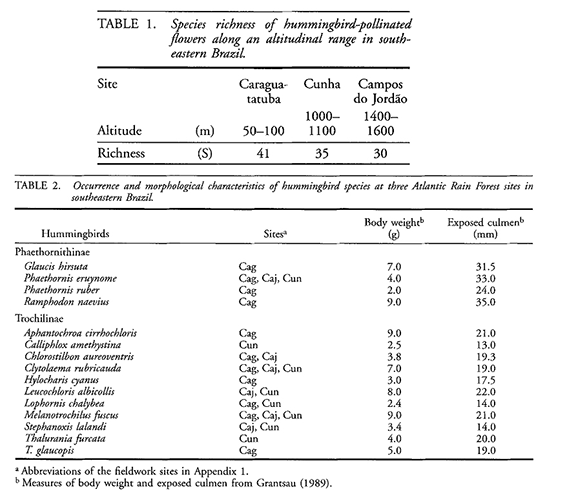
![Figura 1. Segundo a Teoria Moderna da Coexistência [1], a coexistência é possível quando as diferenças de nicho (mecanismos estabilizadores) contrabalanceam ou superam as diferenças na capacidade competitiva (diferenças de fitness) entre as espécies (retirada de [9]). Figura 1. Segundo a Teoria Moderna da Coexistência [1], a coexistência é possível quando as diferenças de nicho (mecanismos estabilizadores) contrabalanceam ou superam as diferenças na capacidade competitiva (diferenças de fitness) entre as espécies (retirada de [9]).](/bie5778/lib/exe/fetch.php?w=400&tok=974573&media=ensaios:fig1_luisa.png)
![Figura 2. Relação entre o ajuste atributo-ambiente e a dispersão em populações e comunidades e sua consequência na montagem de comunidades. Aqui, a dispersão é usada como exemplo de processo que atua na estrutura da comunidade por duas vias distintas: a evolutiva e a ecológica, que diferem na intensidade do processo em que apresentam maior efeito (retirada de [20]). Figura 2. Relação entre o ajuste atributo-ambiente e a dispersão em populações e comunidades e sua consequência na montagem de comunidades. Aqui, a dispersão é usada como exemplo de processo que atua na estrutura da comunidade por duas vias distintas: a evolutiva e a ecológica, que diferem na intensidade do processo em que apresentam maior efeito (retirada de [20]).](/bie5778/lib/exe/fetch.php?w=400&tok=d3f251&media=ensaios:fig2.png)
