Tabela de conteúdos
Ensaios de 2017
É verdade mesmo que a especiação influencia a montagem de comunidades ecológicas?
Melina de Souza Leite
Se perguntarmos a um estudante de ecologia, ou mesmo a um ecólogo profissional, quais os processos mais importantes na montagem de comunidades, uma multitude de mecanismos e processos viriam à mente rapidamente. Contudo, dificilmente a contingência histórica, incluindo-se a especiação, estariam entre os primeiros a serem mencionados – se é que o seriam. Isso porque o histórico de formação teórica da ecologia de comunidades baseou-se por um longo tempo e muito arraigadamente nos processos de nicho (ou seleção senso Vellend (2010)), como competição e predação, na estruturação de comunidades ecológicas e continuam até hoje sendo ensinado como os pilares da ecologia de comunidades. No meio da década de 80, essa percepção começou a mudar quando já havia uma boa quantidade de estudos empíricos que divergiam dos resultados esperados por dinâmicas locais interativas apenas (Ricklefs, 1987). Um exemplo é a diferença na riqueza de espécies em comunidades sob mesmas condições ambientais porém distantes geograficamente, refutando a hipótese da convergência ecológica na montagem de comunidades (Ricklefs, 1987). A partir daí, muito passou-se a ser atribuído a idiossincrasias dos sistemas de estudos, o que impedia os avanços na formulação de uma teoria geral sobre os principais processos estruturadores de comunidades ecológicas (Roughgarden, 2009). Nesse momento, uma visão pluralista da ecologia (McIntosh, 1987) passou a reconhecer que múltiplos fatores podem atuar para determinar a distribuição e abundância das espécies, sendo então dependentes do contexto dos sistemas de estudo. Essa visão pluralista e contexto-dependente veio a culminar, anos depois, em umas das grandes críticas à ecologia de comunidade e sua comunidade científica, com a afirmação de que “a ecologia de comunidades é uma bagunça” (Lawton, 1999).
Como visto acima, o ponto de virada aconteceu quando Ricklefs (1987) trouxe ao debte ecológico um foco na importância em reconhecer de que comunidades locais são marcadas não só por interações locais, mas também por processos históricos e biogeográficos que ocorrem em escala regional e global. Ou seja, o estudo de padrões geográficos de especiação e extinção provém informações sobre os processos que governam o desenvolvimento das biotas regionais e do pool de espécies, que por sua vez influenciam e são influenciados pelos processos em comunidades locais (Cavender-Bares et al., 2009). Um exemplo clássico é a comparação da riqueza de espécies entre comunidades tropicais e temperadas (Mittelbach et al., 2007). O forte decréscimo na diversidade de espécies dos trópicos aos polos em diversos grupos de organismos tem fascinado ecólogos for séculos (Vellend, 2016). Muitas já foram as hipóteses baseadas em nicho para explicar este padrão (Mittelbach et al., 2007). Porém, algo que há muito tempo ficou submerso foi o papel da história geológica influenciando nas taxas de diversificação de espécies (taxa de especiação menos a taxa de extinção). Os ambientes tropicais são tanto mais antigos quanto maiores em área se comparados às regiões temperadas na história geológica da terra (Mittelbach et al., 2007). A hipótese do tempo-e-área prediz que quanto mais tempo e maior a área, maiores as chances de especiação (Wiens et al., 2010), oque levaria a uma maior taxa de diversificação nos trópicos. Por consequência, as comunidades em ambientes tropicais possuem um maior pool de espécies, que nada mais é do que o número de espécies de uma região que são potencialmente colonizadoras das comunidades locais, e o tamanho do pool influencia fortemente a composição e riqueza das comunidades locais (Karger et al., 2015).
Assim, os ecólogos viram que muito da “bagunça” na ecologia de comunidades podia ser, em partes, explicada pelos processos ocorrendo em escalas mais amplas e influenciando a diversidade e coexistência local (Cavender-Bares et al., 2009). O desenvolvimento dessa temática aproximou a ecologia de comunidades à biogeografia histórica (Wiens and Donoghue, 2004), e culminou com a inclusão da especiação como um processo importantíssimo que traz a história evolutiva “para dentro” das comunidades locais, regionais e global (Vellend, 2010). Neste momento, estou chamando de especiação quaisquer processos históricos e biogeográficos atuando sobre as espécies e comunidades que influenciam na montagem de comunidades locais. Os efeitos da especiação no pool regional de espécies, torna-a importante na dinâmica de comunidades locais (Vellend 2010), sendo, junto com a dispersão, um processo que adiciona espécies à comunidade local.
Umas das teorias que formalizou matematicamente a especiação e a influência de um pool regional de espécies nas comunidades locais foi a Teoria Neutra da Biodiversidade de Hubbell (TNB; Hubbell, 2001). Segundo Hubbell (2006), na TNB existe uma “incorporação explícita das ligações entre os processos ecológicos da montagem de comunidades nas escalas locais e os processos evolutivos e biogeográficos em escala mais ampla, como a especiação e a biogeografia” (Hubbell 2006; tradução livre). Nesta visão, a especiação é um processo que acontece apena no pool regional e que vai adicionando espécies para contrabalancear a perda de espécies por extinção estocástica. As dinâmicas do pool e das comunidades locais na metacomunidade1) são independentes e acopladas apenas por dispersão do pool para a metacomunidade. Essa é uma visão simplificada, já que a especiação ocorre nas comunidades e é também influenciada pelos processos que as estruturam, mas avançou no conhecimento por considerar a dinâmica de formação do próprio pool (Mittelbach and Schemske, 2015). De fato, as interações entre dinâmicas ecológicas locais e propriedades físicas e ecológicas das paisagens contribuem fortemente na moldagem de padrões de diversificação em larga escala (Wiens and Donoghue, 2004). Atualmente, novos modelos de especiação em metacomunidades são capazes de reconhecer e incorporar a interação entre a especiação e a dinâmica de comunidades como uma consequência direta da interdependência de mecanismos em escalas locais e regionais ligados por dispersão (Hubert et al., 2015).
Mesmo que a especiação esteja começado a ser contemplada em modelos matemáticos, como o da TNB, não se encontram facilmente estudos empíricos em comunidades explicitando a especiação em modelos estatísticos (Leibold et al., 2010). Realmente, a maioria dos estudos empíricos de comunidades ecológicas na escala local consideram o pool regional de espécies como “fixo”, não havendo necessidade de se incorporá-lo na explicação dos padrões e dinâmicas locais das comunidades (Vellend, 2016). A própria TNB é frequentemente analisada com métodos estatísticos que ignoram a especiação e apenas levam em conta a limitação à dispersão e a deriva gerando o padrão de decaimento de similaridade com a distância entre comunidades (Diniz-Filho et al., 2012; Tuomisto et al., 2012). Um passo importante dado na direção da incorporação da especiação dentro das análises estatísticas de comunidades empíricas foi o uso das relações filogenéticas 2) entre as espécies da comunidade (e.g. Pillar and Duarte, 2010)) como uma aproximação do papel da história evolutiva das espécies na estrutura das comunidades locais (Webb et al., 2002). Adicionalmente, a abordagem filogenética desafia a ideia clássica de que o pool regional de espécies é estático para a escala de tempo na qual as comunidades são montadas (Cavender-Bares et al., 2009).
A incorporação das relações de ancestralidade entre as espécies para explicar padrões em montagem de comunidades ganhou força a partir dos anos 2000 (Webb et al., 2002), formando uma nova área do conhecimento conhecida como Filogenética de Comunidades (Community Phylogenetics). A filogenética de comunidades procura explorar os fatores ecológicos e evolutivos que subjazem a montagem de comunidades e como as interações entre as espécies influencia os processos evolutivos e ecológicos (Pearse et al., 2014). Existem diferentes abordagem estatísticas nesse campo que incorporam de diferentes formas a história evolutiva das espécies em uma análise entre comunidades, como por exemplo o uso de métricas de diversidade filogenética (Tucker et al., 2017). Há também outras abordagens que fazem uso do padrão filogenético – ou seja, a estrutura da árvore filogenética – da comunidade para inferir a importância de processos de nicho por competição ou por filtro ambiental na montagem de comunidades (Webb et al., 2002), mas que ainda são controversos pois assumem premissas nem sempre adequadas (Godoy et al., 2017). Uma destas premissas é o conservadorismo de nicho que assume que espécie próximas taxonomicamente tendem a compartilhar valores de atributos similares (mais similar do que espécies distantes) (Wiens et al., 2010). O conservadorismo de nicho é um ponto delicado da filogenética de comunidades e já foi contestado em diversos estudos (Cavender-Bares et al., 2009), levando ao ceticismo de que os padrões filogenéticos nem sempre nos dizem sobre os processos subjacentes à estruturação de comunidade (Mayfield and Levine, 2010).
Meu projeto de doutorado se insere justamente nas traduções entre teoria ecológica, com seus processos de montagem de comunidades, e métodos estatísticos, que buscam padrões nos dados empíricos. Como eu pretendo abordar os métodos estatísticos sob a perspectiva da teoria de ecologia de comunidades organizada por Vellend (2010), preciso também estudar como os métodos atuais traduzem (se traduzem) os processos de deriva, seleção, dispersão e especiação, em componentes de estatísticos de modelos aplicados a dados empíricos de comunidades ecológicas. Nesse ponto, o aprofundamento nos estudos das influências dos processos históricos e biogeográficos trouxeram luz a um aspecto do meu projeto de doutorado que permanecia pouco explorado: o processo de especiação e suas formas de estudo via métodos estatísticos. Como a filogenética de comunidades é uma área recente, muitos métodos propostos parecem ainda não dialogar eficientemente com a teoria, tanto por questões metodológicas quanto teóricas. Pearse et al. (2014) argumentam que a próxima fronteira metodológica é o desenvolvimento de modelos estatísticos que incorporem a estrutura filogenética ao arcabouço dos modelos em ecologia de comunidades, sendo o próximo passo a quantificação das contribuições relativas dos processos de montagem de comunidades (Vellend, 2016). De qualquer forma, não se deve mais ignorar a especiação como um processo importante não só nas dinâmicas de comunidades locais, mas também na influência das dinâmicas locais no próprio processo de especiação. Eu acredito que daqui a algum tempo, estudantes e ecólogos já terão incorporado a especiação como uma resposta plausível à pergunta feita no início deste ensaio, demonstrando maior maturidade científica no reconhecimento de que ecologia e evolução são indispensáveis no estudo de comunidades ecológicas.
Referências
Cavender-Bares, J., Kozak, K.H., Fine, P.V.A., Kembel, S.W., 2009. The merging of community ecology and phylogenetic biology. Ecology Letters 12, 693–715. https://doi.org/10.1111/j.1461-0248.2009.01314.x
Diniz-Filho, J.A.F., Siqueira, T., Padial, A.A., Rangel, T.F., Landeiro, V.L., Bini, L.M., 2012. Spatial autocorrelation analysis allows disentangling the balance between neutral and niche processes in metacommunities. Oikos 121, 201–210. https://doi.org/10.1111/j.1600-0706.2011.19563.x
Godoy, O., Stouffer, D.B., Kraft, N.J.B., Levine, J.M., 2017. Intransitivity is infrequent and fails to promote annual plant coexistence without pairwise niche differences. Ecology 98, 1193–1200. https://doi.org/10.1002/ecy.1782
Hubbell, S.P., 2006. Neutral theory and the evolution of ecological equivalence. Ecology 87, 1387–1398.
Hubbell, S.P., 2001. The unified neutral theory of biodiversity and biogeography, Monographs in population biology. Princeton University Press, Princeton.
Hubert, N., Calcagno, V., Etienne, R.S., Mouquet, N., 2015. Metacommunity speciation models and their implications for diversification theory. Ecol Lett 18, 864–881. https://doi.org/10.1111/ele.12458
Karger, D.N., Tuomisto, H., Amoroso, V.B., Darnaedi, D., Hidayat, A., Abrahamczyk, S., Kluge, J., Lehnert, M., Kessler, M., 2015. The importance of species pool size for community composition. Ecography 38, 1243–1253. https://doi.org/10.1111/ecog.01322
Lawton, J.H., 1999. Are There General Laws in Ecology? Oikos 84, 177. https://doi.org/10.2307/3546712
Leibold, M.A., Economo, E.P., Peres-Neto, P., 2010. Metacommunity phylogenetics: separating the roles of environmental filters and historical biogeography. Ecology Letters 13, 1290–1299. https://doi.org/10.1111/j.1461-0248.2010.01523.x
Mayfield, M.M., Levine, J.M., 2010. Opposing effects of competitive exclusion on the phylogenetic structure of communities. Ecology Letters 13, 1085–1093. https://doi.org/10.1111/j.1461-0248.2010.01509.x
McIntosh, R.P., 1987. Pluralism in ecology. Annual Review of Ecology and Systematics 18, 321–341.
Mittelbach, G.G., Schemske, D.W., 2015. Ecological and evolutionary perspectives on community assembly. Trends in Ecology & Evolution 30, 241–247. https://doi.org/10.1016/j.tree.2015.02.008
Mittelbach, G.G., Schemske, D.W., Cornell, H.V., Allen, A.P., Brown, J.M., Bush, M.B., Harrison, S.P., Hurlbert, A.H., Knowlton, N., Lessios, H.A., McCain, C.M., McCune, A.R., McDade, L.A., McPeek, M.A., Near, T.J., Price, T.D., Ricklefs, R.E., Roy, K., Sax, D.F., Schluter, D., Sobel, J.M., Turelli, M., 2007. Evolution and the latitudinal diversity gradient: speciation, extinction and biogeography. Ecology Letters 10, 315–331. https://doi.org/10.1111/j.1461-0248.2007.01020.x
Pearse, W.D., Purvis, A., Cavender-Bares, J., Helmus, M.R., 2014. Metrics and Models of Community Phylogenetics, in: Garamszegi, L.Z. (Ed.), Modern Phylogenetic Comparative Methods and Their Application in Evolutionary Biology. Springer Berlin Heidelberg, Berlin, Heidelberg, pp. 451–464. https://doi.org/10.1007/978-3-662-43550-2_19
Pillar, V.D., Duarte, L. d. S., 2010. A framework for metacommunity analysis of phylogenetic structure. Ecology Letters 13, 587–596. https://doi.org/10.1111/j.1461-0248.2010.01456.x
Ricklefs, R.E., 1987. Community Diversity: Relative Roles of Local and Regional Processes. Science 235, 167–171. https://doi.org/10.1126/science.235.4785.167
Roughgarden, J., 2009. Is there a general theory of community ecology? Biology & Philosophy 24, 521–529. https://doi.org/10.1007/s10539-009-9164-z
Tucker, C.M., Cadotte, M.W., Carvalho, S.B., Davies, T.J., Ferrier, S., Fritz, S.A., Grenyer, R., Helmus, M.R., Jin, L.S., Mooers, A.O., Pavoine, S., Purschke, O., Redding, D.W., Rosauer, D.F., Winter, M., Mazel, F., 2017. A guide to phylogenetic metrics for conservation, community ecology and macroecology. Biol Rev 92, 698–715. https://doi.org/10.1111/brv.12252
Tuomisto, H., Ruokolainen, L., Ruokolainen, K., 2012. Modelling niche and neutral dynamics: on the ecological interpretation of variation partitioning results. Ecography 35, 961–971. https://doi.org/10.1111/j.1600-0587.2012.07339.x
Vellend, M., 2016. The theory of ecological communities, Monographs in Population Biology. Princeton University Press.
Vellend, M., 2010. Conceptual synthesis in community ecology. The Quarterly review of biology 85, 183–206. Webb, C.O., Ackerly, D.D., McPeek, M.A., Donoghue, M.J., 2002. Phylogenies and Community Ecology. Annual Review of Ecology and Systematics 33, 475–505. https://doi.org/10.1146/annurev.ecolsys.33.010802.150448
Wiens, J.J., Ackerly, D.D., Allen, A.P., Anacker, B.L., Buckley, L.B., Cornell, H.V., Damschen, E.I., Jonathan Davies, T., Grytnes, J.-A., Harrison, S.P., Hawkins, B.A., Holt, R.D., McCain, C.M., Stephens, P.R., 2010. Niche conservatism as an emerging principle in ecology and conservation biology. Ecology Letters 13, 1310–1324. https://doi.org/10.1111/j.1461-0248.2010.01515.x
Wiens, J.J., Donoghue, M.J., 2004. Historical biogeography, ecology and species richness. Trends in Ecology & Evolution 19, 639–644. https://doi.org/10.1016/j.tree.2004.09.011
Diversidade regional e diversidade local: conceito chave para ecologia de paisagem
Sebastián Alvarado Montero
Nos últimos 30 anos, os ecólogos começaram a se interessar na diferenciação na escala espacial dos processos que determinam a composição das comunidades biológicas. Originalmente, o foco da ecologia de comunidades era a riqueza local. Esta, segundo Srivastava (2009), abrange uma escala espacial o suficientemente pequena como para que todas as espécies possam se encontrar mutuamente no tempo ecológico e assim interatuar. Ampliando a escala, entra a riqueza regional. Essa riqueza regional, ou o pool regional de espécies, contem todas as espécies que eventualmente colonizariam uma localidade (Srivastava 2009). Isto é tomando a exclusão competitiva como pouco importante na dinâmica da comunidade. Desse modo, a riqueza local será moldada no nível local por relações intra e interespecíficas como competição e predação, assim como distúrbios no ambiente. No entanto, a riqueza regional é influenciada por processos como a imigração, a especiação e as circunstâncias históricas particulares da escala regional (Ricklefs 1987). Porém, os processos nas duas escalas estão interconectados, relacionando a riqueza local com a regional. Na escala local a predação e os distúrbios, assim como a diferenciação de nicho, relaxam a competição interespecífica e disponibilizam nichos no ecossistema, criando uma comunidade não saturada ou não interativa que permite a imigração de espécies do pool regional e assim aumenta a riqueza local enquanto aumenta a riqueza regional. Localidades saturadas ou interativas apresentam nichos cheios ou parcialmente cheios, criando interações diretas ou indiretas fortes, o que provoca problemas de coexistência (Cornell & Harrison 2014). Dois modelos em que o problema da competição diminui são a heterogeneidade de nicho (as espécies diminuem o nicho realizado e evitam a sobreposição com competidores) e a heterogeneidade espaço-temporal (Cornell & Lawton 1992). Esta última pode ser atingida de cinco formas: tendo habilidades competitivas similares e recrutamento imprevisível, reduzindo a competição interespecífica respeito à intraespecífica através da agregação, por meio de distúrbios periódicos junto com baixas taxas de crescimento populacional, misturando de espécies fugitivas com espécies competitivamente superiores, e variações espaciais no risco de ataque de predadores especialistas sobre novos recrutas de uma população (Cornell & Lawton 1992). Nestas comunidades saturas, ou interativas, o efeito do pool regional não é tão forte sobre as comunidades locais.
Esta ampliação na perspectiva da ecologia ajudou compreender melhor os processos que determinam a formação das comunidades biológicas, permitindo assim uma descrição mais realista dos mecanismos por trás desses fatores. No entanto se pensava que a diversidade de espécies dependia basicamente das interações bióticas e abióticas na localidade, o conceito do pool regional demonstrou a importância dos processos a maior escala que estavam sendo ignorados na explicação da riqueza de espécies, como são a especiação, a dispersão, a deriva e a seleção que pode ocorrer também no nível regional (Vellend 2010). Como as regiões não são todas iguais e, ao contrário, têm particularidades históricas, virou de muita importância também entender como essas características afetam o pool regional. Características como a área da região, a sua heterogeneidade e produtividade são importantes na determinação do pool regional, influenciando o pool regional através da capacidade de carga da região e a disponibilidade de nichos (Harrison & Cornell 2008).
As características que determinam a riqueza do pool regional são o principal foco da ecologia de paisagem, que estuda o efeito da composição da paisagem nas populações e comunidades que a ocupam (Forman 1995). Um dos principais questionamentos na relação da riqueza local-regional é se as comunidades podem estar saturadas ou não (Cornell 1985). Esta pergunta é muito importante na ecologia de paisagem pelas implicações que as características da paisagem podem ter na resistência das comunidadeslocais à invasão de espécies exóticas. A insaturação da comunidade é devido ao efeito que os distúrbios e a dispersão limitada têm sobre a intensidade de competição, enfraquecendo as interações das espécies nativas e aumentado a influência do pool sobre as comunidades locais ao aumentar a disponibilidade de nicho (Belote et al. 2009, Myers & Harms 2011). Na escala de paisagens, tanto o distúrbio como as barreiras na dispersão de espécies são criados a partir da fragmentação dos ambientes naturais, reduzindo-os e isolando-os. Isto faz que os remanentes naturais não consigam suportar as espécies que requerem de fragmentos maiores e que mantenham as propriedades do hábitat natural (Fahrig 2003). Isso abre as comunidades locais dos fragmentos ao pool regional. A pergunta chave em ecologia de paisagem é “Abre-as para qual pool?”.
A particularidade da ecologia de paisagem é que os ambientes estudados, além do componente natural, também apresentam um componente antrópico, seja este cidades, campos agrícolas… As atividades humanas nesses ambientes inserem na paisagem espécies introduzidas (Patricelli & Blickley 2006), criando um pool regional exótico. Entre maior o grau de fragmentação e a redução do hábitat natural nas paisagens, mais susceptível serão as comunidades locais a esse pool regional exótico, o que pode levar a extinção das espécies nativas que ainda a conformam. Daí a importância de entender o funcionamento das comunidades não somente no nível local, senão também a influência que a escala da paisagem tem sobre os fragmentos. A partir da compreensão dos mecanismos responsáveis pela riqueza de espécies nas duas escalas é possível desenvolver estratégias para evitar a perda de diversidade ante as atividades antrópicas.
O objetivo do meu trabalho de pesquisa é determinar o efeito da estrutura da paisagem na composição da comunidade de insetos necrófagos e no fornecimento do serviço ecossistêmico de remoção da carniça nos ambientes antrópicos. O conceito do pool regional é chave para minha pesquisa porque ajuda entender como as características da paisagem influenciam no pool regional nativo e ao mesmo tempo afeta a riqueza local nos fragmentos. Como expliquei anteriormente, paisagens com maior cobertura florestal, ou seja, com maior área de hábitat e maior produtividade para as comunidades nativas, terão um pool regional mais rico do que paisagens com pouca cobertura florestal e maior grau de fragmentação. O maior grau de cobertura florestal também reduz o impacto dos distúrbios, criando um ambiente mais estável (Carrara et al. 2015). Dessa forma, as comunidades locais têm uma menor influência do pool regional. No caso do pool exótico, comunidades locais saturadas em paisagens antrópicos poderiam resistir melhor a invasão dessas espécies introduzidas, que eventualmente podem levar à perda de diversidade nativa. Por outra parte, um pool regional diverso é ideal no fornecimento do serviço ecossistêmico, dado que a eficiência do serviço está relacionada com a diversidade de espécies da comunidade (Olson et al. 2012). Assim, o entendimento do pool regional e a sua influência na comunidade local de insetos necrófagos permite explicar melhor o efeito da estrutura da paisagem nessa comunidade e o fornecimento do serviço ecossistêmico, permitindo tomar decisões de conservação mais certeiras e melhor fundamentadas.
Referências bibliográficas
Belote, R.T, N.J. Sanders & Jones, R.H. 2009. Disturbance alters local-regional richness relationships in Appalachian forests. Ecology 90:2940-2947.
Carrara, E., V. Arroyo-Rodríguez, J.H. Vega-Rivera, J.E. Schondube, S.M. de Freitas & Fahrig, L. 2015. Impact of landscape composition and configuration on forest specialist and generalist bird species in the fragmented Lacandona rainforest, Mexico. Biological Conservation. 184:117-126.
Cornell, H.V. 1985. Local and regional richness of cynipine gall wasps on California oaks. Ecology 66:1247-1260.
Cornell, H.V. & Harrison, S.P. 2014. What are species pools and where are they important? Annual Review of Ecology, Evolution and Systematics 45:45-67.
Cornell, H.V. & Lawton, J.H. 1992. Species interactions, local and regional processes, and limits, to the richness of ecological communities: a theoretical perspective. Journal of Animal Ecology 61:1-12.
Fahrig, L. 2003. Effects of habitat fragmentation on biodiversity. Annual Review of Ecology, Evolution, and Systematics 34:487-515.
Forman, R.T.T. 1995. Some general principles of landscape and regional ecology. Landscape Ecology 10:133-142.
Harrison, S. & Cornell, H. 2008. Toward a better understanding of the regional causes of local community richness. Ecology Letters 11:969-979.
Myers, J.A. & Harms, K.E. 2011. Seed arrival and ecological filters interact to assemble high-diversity plant communities. Ecology 92:2678-686.
Olson Z.H., J.C. Beasley, T.L. DeVault & Rhodes Jr. O.E. 2012. Scavenger community response to the removal of a dominant scavenger. Oikos. 121:77-84. Patricelli, G.L. & Blickley, J.L. 2006. Avian communication in urban noise: causes and consequences of vocal adjustment. The Auk 123:639-649.
Ricklefs, R.E. 1987. Community Diversity: relative roles of local and regional processes. Science 235:167-171.
Srivastava, D.S. 1999. Using local-regional richness plots to test for species saturation: pitfalls and potentials. Journal of Animal Ecology 68:1-16.
Vellend, M. 2010. Conceptual synthesis in community ecology. The Quarterly Review of Biology 85:183-206.
Aplicação do conceito de resiliência no manejo de agroecossistemas sustentáveis
Manuela Franco de Carvalho da Silva Pereira
O conceito de resiliência proposto por Holling (1973) corresponde à habilidade de um sistema de absorver perturbações e se reorganizar enquanto passa por essa mudança, de forma a manter o mesmo estado, a saber, manter as mesmas funções, estrutura, identidade e mecanismos de manutenção. Esta capacidade é limitada, dado que fatores que podem provocar a perda de resiliência tornam o sistema mais vulnerável a mudanças de regime. A perda de resiliência pode se dar gradualmente, como resultado de contínuas perturbações ao sistema e, estocasticamente, uma pequena perturbação pode levar a uma transição crítica que não pode ser imediatamente relacionada ao impacto que a provocou (HOLLING, 1973; SCHEFFER, 2009). Outros autores entendem resiliência como a velocidade de recuperação de um sistema (que também pode ser sinônimo de elasticidade). Essa variação de definições para conceitos relacionados à estabilidade de um sistema foi explorada por Grimm e Wissel (1996), que identificaram nessa variação uma necessidade de melhor definir os processos que compõem esse estado.
De maneira geral, a ideia de uma habilidade de recuperação que resulta em uma persistência das relações que constituem um sistema é adequada para justificar a abordagem de Holling (1973), que propõe o olhar para sistemas ecológicos com a perspectiva da resiliência ao invés da estabilidade. Isso representou um marco para a teoria ecológica em um momento em que se buscava compreender os fatores que levam a um equilibrium que garantiria a estabilidade de um sistema. O conceito de resiliência proposto por este autor trouxe consigo uma nova forma de abordar os estados de estabilidade ao reconhecer as flutuações como parte dela e possibilitou o avanço de estudos sobre transições críticas e outras respostas dos sistemas ecológicos a mudanças. O autor também desenvolveu a noção de uma paisagem de estabilidade onde diferentes bacias de atração se apresentam como possíveis regimes para o mesmo sistema, sob as mesmas condições (estados estáveis alternativos), cada um com sua condição de resiliência. Assim a existência ou a extinção de um sistema ecológico não seriam as duas únicas expressões prováveis de conceber seu estado equilíbrio, isto porque embora mecanismos de extinção e flutuações existam para desorganizar as comunidades bióticas, estas são sistemas complexos adaptativos, com mecanismos de auto-organização que tendem a estabilizar o sistema. Essa noção também contribuiu para uma nova perspectiva de manejo para a restauração e conservação de ecossistemas.
Figura 1: Sistemas adaptativos complexos passa por um ciclo adaptativo cujos mecanismos de feedback levam à estabilização em quatro fases: a fase de exploração ® ou de implantação de um sistema; a fase de conservação em que o sistema se consolidação (k); a fase de destruição onde sistema sofre um impacto que o altera ( ? ); a fase de reorganização ( ? ). A resiliência do sistema é maior quanto mais vezes ele passou por esse ciclo (HOLLING, 1986 apud RESILIENCE ALIANCE, 2017).
A aplicação de um Pensamento Resiliente (Resilience Thinking) traz a perspectiva de que as flutuações são comuns e as respostas dadas por ciclos adaptativos contribuem para a persistência dos sistemas. Esse reconhecimento da resiliência como importante processo de manutenção dos ecossistemas possibilita a permanência em um mundo complexo, onde eficiência e otimização não seriam mais os parâmetros a serem buscados em um sistema socioecológico, já que estes não garantem a permanência das comunidades e, portanto, a sustentabilidade dos sistemas socioecológicos (WALKER e SALT, 2012). Embora pareça contraintuitivo, um manejo baseado na resiliência foca na capacidade de absorção das mudanças provocadas como forma de fortalecer a persistência. Entendendo que perturbações são parte da dinâmica dos sistemas ecológicos, estas geram um ciclo de reorganização que cria uma janela de oportunidade para a deriva e/ou dispersão, com a implantação de uma nova espécie, por exemplo. Não se trata, porém, de apenas provocar perturbações sucessivas para acelerar novos ciclos adaptativos, já que uma sequência de distúrbios pode reduzir a resiliência do sistema e deixando o sistema vulnerável a mudanças catastróficas3). Um manejo baseado na resiliência deve aceitar flutuações, olhar os eventos em contexto regional e enfatizar a heterogeneidade. Não se trata de tentar prever o futuro e criar sistemas resistentes às mudanças, mas de conceber sistemas que possam absorver as mudanças e acomodar-se a eventos inesperados (HOLLING, 1973).
Em Agroecologia, o conceito de resiliência assume uma perspectiva socioecológica (WALKER et al, 2004). Assim, entende-se que os fatores que determinam a resiliência de um agroecossistema é resultado da ação humana em interação com um meio. Darnhofer et al (2010) propõe que um agroecossistema como um complexo adaptativo cuja sustentabilidade é atingida através da adaptação e da mudança. Quando agricultores colocam a dinâmica de produção em sintonia com a capacidade suporte do local também dão ênfase a processos de aprendizado e inovação necessários ao ciclo adaptativo de sistemas socioecológicos. Para os autores, o manejo de uma unidade agrícola focada na resiliência difere do manejo agrícola convencional, que busca um equilíbrio do agroecossistema a partir de uma perspectiva linear, que busca a predição (de eventos, de resultados de safra e outros) e a otimização (maximização da produtividade agrícola) a partir especialmente da homogeneidade e simplificação.
Entender que a resiliência é um processo que contribui na estabilidade de um ecossistema leva também a um possível redirecionamento das práticas de manejo agrícola que promovam mecanismos de feedback que promovam ciclos adaptativos, dinamizando o agroecossistema (ALTIERI et al, 2015). Para isso, a diversidade tem papel central, já que tanto a redundância (diversas espécies em um mesmo grupo funcional) quanto a complementariedade (diferentes espécies que se complementam para explorar ao máximo seu nicho, aumentando a produtividade do sistema) são aspectos que garantem a adaptabilidade, resposta da resiliência do agroecossistema (ELMQVIST et al, 2003; FOLKE et al, 2004).
No caso de um manejo de sistema agroflorestal práticas comuns são as podas (pequenas perturbações) e derrubadas (promovem transições críticas). Com as podas, a alteração do ambiente pela abertura do dossel, permitindo a entrada de radiação visível (luz) no sistema aumenta a taxa fotossintética do sistema e possibilita a emergência de novas espécies que não compuseram o sistema até então (podendo ser introduzidas ou emergentes do banco de sementes do solo). Além disso, com a deposição de material podado sobre o solo, os mecanismos de feedback que mantêm a ciclagem de nutrientes são acelerados. Ao promover essa mudança adaptativa sem uma alteração drástica, há um ciclo de reorganização, onde a disponibilização de nutrientes e o aumento da fotossíntese, por exemplo, levam ao aumento da taxa de produtividade primária em uma área em que se encontrava limites produtivos (SAFRIEL; NJENGA; LEEUW, 2014). Outros mecanismos que podem ser observados podem resultar na regulação de insetos ou patógenos por interações conduzidas por processos de dispersão, deriva ou seleção que são facilitados a partir da nova condição de luminosidade.
Em um momento de fragilidade dos agroecossistemas, com reduzida capacidade produtiva, a perspectiva do pensamento resiliente pode trazer novas referências ao manejo de agroecossistemas de forma a garantir a permanência humana. Por outro lado, resta questionar se não caberia uma perspectiva que vá para além da adaptabilidade, discutida aqui como uma estratégia necessária, mas assuma a transformabilidade como princípio, reconduzindo criticamente os sistemas socioecológicos a um novo estado.
Referências bibliográficas
ALTIERI, M. A. et al. Agroecology and the design of climate change-resilient farming systems. Agronomy for Sustainable Development, v. 35, n. 3, p. 869-890, 2015.
DARNHOFER, I.; FAIRWEATHER, J.; MOLLER, H. Assessing a farm's sustainability: insights from resilience thinking. International journal of agricultural sustainability, v. 8, n. 3, p. 186-198, 2010.
ELMQVIST, T.; FOLKE,C.; NYSTRÖM, M.; PETERSON. G.; BENGTSSON, J.; WALKER, B.; NORBERG, J. Response diversity, ecosystem change, and resilience. Frontiers in Ecology and the Environment, v. 1, n. 9, p. 488-494, 2003.
GRIMM, V.; WISSEL, C. Babel, or the ecological stability discussions: an inventory and analysis of terminology and a guide for avoiding confusion. Oecologia, v. 109, n. 3, p. 323-334, 1997.
HOLLING, C. S. Resilience and stability of ecological systems. Annual review of ecology and systematics, v. 4, n. 1, p. 1-23, 1973.
HOLLING, Crawford S. The resilience of terrestrial ecosystems: local surprise and global change. Sustainable development of the biosphere, v. 14, p. 292-317, 1986.
SAFRIEL, U.; NJENGA, M.; DE LEEUW, J. Conceptual framework on trees and resilience. In: DE LEEUW, J. et al. (ed.) Treesilience. An assessment of the resilience provided by trees in the drylands of Eastern Africa. Nairobi, Kenya: The World Agroforestry Centre (ICRAF), 2014. p. 17-24
SCHEFFER, Marten. Critical transitions in nature and society. Princeton University Press, 2009. p.
RESILIENCE ALLIANCE Key concepts: Adaptive cycle. Disponível em: <https://www.resalliance.org/adaptive-cycle>. Acesso em: 20 de dezembro de 2017. WALKER, B.; HOLLING, C. S.; CARPENTER, S. R.; KINZIG, A. Adaptability and Transformability in Social-Ecological Systems. Ecology and Society, 9:5, 2004.
WALKER, B., SALT, D. Living in a complex world: an introduction to resilience thinking. In: ___ Resilience thinking: sustaining ecosystems and people in a changing world. Island Press, 2012. p. 01 – 14.
"Diz-me quem és e dir-te-ei onde estás": nicho, filogenia e composição de comunidades de serpentes
Filipe A. Cabreirinha Serrano
Conceito:
Um episódio anedótico conta que quando um grupo de teólogos perguntou a J.B.S. Haldane, um proeminente cientista no campo de genética e fisiologia, o que este poderia concluir a respeito de deus ele terá respondido que este tinha “an inordinate fondness for beetles.“ 4)”. É deveras impressionante que tão extraordinário número de espécies possa existir (~350.000 espécies descritas, com uma projeção de ~1.5 milhões extantes segundo Stork et al. (2015)). Como é possível que possam coexistir tantas espécies de um único clado? Uma das respostas na ponta da língua dos ecólogos tem sido “nicho”. Diferentes nichos, coexistência facilitada. Mas o que é o nicho? Adotado para ecologia por Grinnell (1914, 1917), inicialmente “nicho” referia-se às condições necessárias para a existência da espécie - limitações morfológicas, tolerâncias fisiológicas, hábitos alimentares e interações com outras espécies da comunidade. Elton (1927) propôs que o nicho duma espécie significava onde na cadeia alimentar esta se situava e do que se alimentava. Posteriormente, avanços teóricos e matemáticos por Hutchinson (1957, 1965) e MacArthur (1958, 1969) permitiram a quantificação do nicho e seus componentes - sobreposição, partição e amplitude (partilha, complementariedade e extensão de recursos utilizados, respetivamente), mas a definição e consequente uso de “nicho” continuou sofrendo de alguma ambiguidade.
Embora seja central na formulação e teste de hipóteses em ecologia, a polissemia de “nicho” tem representado um obstáculo à correta interpretação dos resultados obtidos (Chase & Leibold, 2003). Doravante, uso nicho como “Condições ambientais que satisfazem os requisitos mínimos de uma espécie de forma a que uma população local sua tenha taxa de nascimentos no mínimo igual à sua taxa de mortes associadas aos efeitos per capita desta espécie nestas condições ambientais” per Chase & Leibold (2003). É importante ressaltar que, ainda que nicho não seja um espaço físico, ele se manifesta na ocupação de determinado local num determinado tempo e que é resultado de processos evolutivos.
Importância:
O conceito de nicho tem permeado a discussão ecológica e tem sido vital para teorias constituintes de ecologia de comunidades (Pianka, 1999). Segundo a definição aqui utilizada, nicho está intimamente associado a fitness (“… taxa de nascimentos no mínimo igual à sua taxa de mortes…”). Ao fitness estão associadas várias caraterísticas (traits) que permitem aos indivíduos da espécie obter energia, evitar inimigos e reproduzir-se (McGill et al., 2006). Utilizando o conceito de nicho, inúmeros estudos têm abordado como a diferenciação de caraterísticas permite a coexistência de espécies (MacArthur & Levins, 1967; Tilman, 1982; Chesson, 2000; Kraft et al., 2015). Desta forma, estudos abordando nicho têm sido fundamentais para o desenvolvimento de uma perspetiva local de ecologia de comunidades, onde interações interespecíficas e condições abióticas são os principais fatores influenciando composição e diversidade da comunidade (Tilman, 1997).
Visto que o fitness é uma métrica (e requisito) de subsistência de uma espécie e que este depende de condições ambientais que variam geografica e/ou temporalmente (Amarasekare & Nisbet, 2001), o seu nicho será determinante na distribuição da espécie. Assim, para prever a área de distribuição real ou potencial de uma espécie, a ecologia desenvolveu preciosas ferramentas de modelagem utilizando as relações de uma espécie com os seus requisitos abióticos, suas tolerâncias fisiológicas e até com outras espécies presentes na comunidade locais. Um exemplo das ferramentas mais utilizadas é o Ecological Niche Modelling (ENM) (Araújo & Guisan, 2006), podendo inferir estas relações através dos parâmetros das localidades conhecidas da espécie ou de experimentos mecanísticos que oferecem uma visão mais criteriosa e detalhada do seu comportamento face aos componentes bióticos e abióticos do nicho (Kearney, 2006). Com esta ferramenta, podemos prever como as comunidades reagirão a alterações climáticas (Wake et al., 2009), o quanto possíveis espécies invasoras vão impactar comunidades (Wiens et al., 2009) ou até desvendar o nicho de criaturas mitológicas (Lozier at al., 2009).
No entanto, a teoria de nicho não raramente utiliza uma visão redutora e simplista focada apenas em processos à escala local. A esta escala, os processos determinantes de estruturação das comunidades são a interação de espécies (fortemente influenciada por dinâmicas de população) e limitações abióticas. O nicho de uma espécie tem de ser contextualizado também no plano espacio-temporal: como processos de larga escala (e.g. processos biogeográficos a nível continental) e processos na escala evolutiva (Ricklefs & Jenkins, 2011) pois este é o reflexo de todos estes processos complexos, indissociáveis a onde e quando esta surgiu e se adaptou. Assim, o que anteriormente era atribuído a fatores contingentes de cada comunidade ecológica podem ser explicado por processos de escala mais ampla como os históricos e evolutivos (Webb et al., 2002; Holt, 2009; Lessard et al., 2012). Esta perspetiva tem vindo a ganhar tração e a oferecer novos insights para a estruturação de comunidades. Godoy et al., (2014) estudaram como a relação filogenética de plantas anuais de planícies da Califórnia explicava os resultados da sua competição aquando da sua coexistência, Wiens (2011) mostrou como existe apenas um clado de relas originado em cada região, embora clados com características análogas possam posteriormente colonizar essa região, e Zhao et al., (2015) investigaram como a evolução pode alterar os mecanismos de coexistência de espécies, embora a nível de microcosmos. Considerar biogeografia também pode ser útil. Por um lado a especiação alopátrica (originada quando uma barreira impede o fluxo génico entre uma população) pode levar a uma potencial evolução separada e idiossincrática, onde a divergência de nicho também aumenta (Mittelbach & Schemske, 2015) mas, como proposto por Wiens (2004), a tendência das espécies pode também ser de reter o nicho ecológico ao longo do processo de evolução pela incapacidade de adaptação a outras condições abióticas. Ainda assim, a escala evolutiva é indispensável para melhor apurar quanto o nicho de espécies filogeneticamente relacionadas é semelhante. Enquanto que espécies que tenham divergido recentemente possam exibir semelhança nas tolerâncias abióticas e utilização de recursos (Harvey & Pagel, 1991; Losos, 2008), clados que tenham divergido há mais tempo podem apresentar diferenças no seu nicho geradas pela evolução alopátrica. Uma abordagem extramente útil para considerar todos estas vertentes do nicho é o Conservatismo Filogenético de Nicho (PNC), onde se estuda a relação entre as semelhanças ecológicas e filogenéticas (Harvey & Pagel, 1991; Peterson et al., 1999; Ackerly, 2003), e que contribui para o entendimento de como o nicho histórico do(s) clado (s) pode informar sobre os nichos atuais das espécies e sobre os seus padrões biogeográficos (Wiens & Donoghue, 2004; Losos, 2008; Nunes & Pearson, 2016).
Contexto na pesquisa:
O meu projeto de Doutorado, intitulado “Diversidade filogenética, riqueza e conservação de serpentes Dipsadidae na América do Sul cisandina”, visa entender quais os padrões de distribuição tanto da história evolutiva como do número de espécies da maior família de serpentes do continente sul-americano. Embora não sejam formalmente estudadas as relações com as condições bióticas e a escala seja bastante ampla, o conceito de nicho será vital para perceber a distribuição geográfica dos vários componentes de fauna desta família. Esta será a primeira abordagem tentativa de compreensão dos padrões de diversidade da herpetofauna ao nível continental mas outros autores fizeram contribuições extremamente importante a nível regional para que os processos biogeográficos e evolutivos possam ser incluídos. Entre outros, Cadle & Greene (1993) referem que a existência de serpentes com hábitos característicos se deve não a limitações ecológicas mas sim a contingências históricas e evolutivas (e.g. alta frequência de gastrópodes na dieta de serpentes não é um reflexo da escassa abundância de outras presas mas sim de um componente filogenético caraterístico desse clado) e França et al., (2008) concluíram que a filogenia era o fator mais importante na estruturação de comunidades de herpetofauna do Cerrado brasileiro.
No primeiro capítulo da minha tese, surgido pela curiosidade despertada pela aparente diferença de utilização de habitat de serpentes, vou abordar como o PNC pode informar sobre a composição de espécies de Dipsadidae numa comunidade. Esta família é composta de dois clados: Dipsadinae, de origem mesoamericana e Xenodontinae, de origem sul-americana (Cadle, 1984). Segundo Cadle (1985), espécies da sub-família Dipsadinae apresentam, na sua maioria, corpos elongados e menores pesos que favorecem arborealidade ao invés das espécies de Xenodontinae que são mais pesadas e tendencialmente mais terrícolas. Assim, a minha predição é de que em regiões florestais as comunidades de serpentes da família terão uma percentagem de espécies de Dipsadinae mais alta ou até maioritária (maior de 50%), enquanto que nas zonas abertas a composição será tendencialmente enviesada para espécies de Xenodontinae. Se isto se verificar, então cada clado apresenta o seu nicho relativamente conservado e os padrões de diversidade filogenética vão refletir a composição dessa comunidade. Os resultados iniciais parecem confirmar uma relação significativa entre as características ecológicas do local e a estruturação da comunidade, realçando a importância de considerar a filogenia e nicho dos seus elementos.
Com o aumento da disponibilidade de boas hipóteses filogenéticas e de bons dados de distribuição geográfica encontramo-nos agora numa janela de oportunidade perfeita para entender os processos por detrás dos padrões de diversidade tendo o conceito de “nicho” como pilar fundamental. Originado no início do século XX, discutido e definido por inúmeros autores e até mesmo questionado (Hubell, 2001), o nicho continua a ser um conceito central em ecologia e que, após uma atribulada história, aliado a perspetivas contemporâneas (de processos históricos) pode agora perpetuar a sua utilidade no panorama da ecologia de comunidades e finalmente ajudar a responder por que raio existem tantos “besouros”.
Referências
Ackerly, D.D. 2003. Community assembly, niche conservatism, and adaptive evolution in changing environments. International Journal of Plant Sciences, 164(S3), pp.S165-S184.
Amarasekare, P. and Nisbet, R.M. 2001. Spatial heterogeneity, source-sink dynamics, and the local coexistence of competing species. The American Naturalist, 158(6), pp.572-584.
Araújo, M.B. & Guisan, A. 2006. Five (or so) challenges for species distribution modelling. Journal of Biogeography, 10, 1677–1688.
Cadle, J.E., 1984. Molecular systematics of Neotropical xenodontine snakes. III. Overview of xenodontine phylogeny and the history of New World snakes. Copeia, pp.641-652.
Cadle, J.E., 1985. The Neotropical colubrid snake fauna (Serpentes: Colubridae): lineage components and biogeography. Systematic Zoology, 34(1), pp.1-20.
Cadle, J.E. & Greene, H.W. 1993. Phylogenetic patterns, biogeography, and the ecological structure of neotropical snake assemblages. Pp. 281-293. In: Rickfles, R.E. and Schluter, D. (Eds.). Species diversity in ecological communities: historical and geographical perspectives. The University of Chicago Press: Chicago.
Chase, M. & Leibold, A. 2003. Ecological Niches: Linking Classical and Contemporary Approaches. University of Chicago Press: Chicago.
Chesson, P. 2000. General theory of competitive coexistence in spatially-varying environments. Theoretical Population Biology 58:211–237.
Elton, C. 1927. Animal ecology. Sidwick & Jackson, London.
França, F.G. et al. 2008. Phylogeny and ecology determine morphological structure in a snake assemblage in the Central Brazilian Cerrado. Copeia, 2008:20-36.
Grinnell, J. 1917. The niche-relationship of the California trasher. Auk, 34, pp. 427-433.
Grinnell, J. 1924. Geography and evolution. Ecology, 5 (3), pp. 225-229.
Godoy, O., Kraft, N.J. and Levine, J.M., 2014. Phylogenetic relatedness and the determinants of competitive outcomes. Ecology Letters, 17(7), pp.836-844.
Harvey, P.H. & Pagel, M.D. 1991. The Comparative Method in Evolutionary Biology. Oxford University Press: Oxford.
Holt, R.D. 2009. Bringing the Hutchinsonian niche into the 21st century: ecological and evolutionary perspectives. Proceedings of the National Academy of Sciences, 106 (Supplement 2), pp.19659-19665.
Hubbell, S. P. 2001. The uni?ed neutral theory of species abundance and diversity. Princeton: Princeton University Press.
Hutchinson, G.E. 1957. Concluding Remarks. Cold Spring Harbor Symp. Quant. Biol., 22, pp. 425-427.
Hutchinson, G.E. 1965. The ecological theater and the evolutionary play. New Haven: Yale University Press.
Kearney, M. 2006. Habitat, environment and niche: what are we modelling?. Oikos, 115(1), pp.186-191.
Kraft, N.J., Adler, P.B., Godoy, O., James, E.C., Fuller, S. and Levine, J.M. 2015. Community assembly, coexistence and the environmental filtering metaphor. Functional Ecology, 29(5), pp.592-599.
Lessard, J., Borregaard, M., Fordyce, J. et. al. 2012. Strong influence of regional species pools on continent-wide structuring of local communities. Proceedings of the Royal Society B, 279: 266-274.
Losos, J.B. 2008. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species. Ecology Letters, 11: 995-1007.
Lozier, J.D., Aniello, P. and Hickerson, M.J. 2009. Predicting the distribution of Sasquatch in western North America: anything goes with ecological niche modelling. Journal of Biogeography, 36(9), pp.1623-1627.
MacArthur, R.H. 1958. Population ecology of some warbles of northeastern Coniferous forest. Ecology, 39 (4), pp. 599-619.
MacArthur, R. H. 1969. The theory of the niche. In Population biology and evolution, ed. R. C. Lewontin, 159–176. Syracuse: Syracuse University Press.
MacArthur, R. H., and R. Levins. 1967. The limiting similarity, convergence, and divergence of coexisting species. The American Naturalist 101:377–385.
McGill, B.J., Enquist, B.J., Weiher, E. and Westoby, M., 2006. Rebuilding community ecology from functional traits. Trends in Ecology &Evolution, 21(4), pp.178-185.
Mittelbach, G.G. and Schemske, D.W., 2015. Ecological and evolutionary perspectives on community assembly. Trends in ecology & evolution, 30(5), pp.241-247.
Nunes, L.A. & Pearson, R.G. 2016. A null biogeographical test for assessing ecological niche evolution. Journal of Biogeography, 44(6), pp.1331-1343.
Peterson, A.T., Soberon, J. & Sanchez-Cordero, V. 1999. Conservatism of ecological niches in evolutionary time. Science, 285, pp. 265–267.
Pianka, E. R. 1999. Putting communities together. Trends in Ecology & Evolution, 14, pp. 501–502.
Ricklefs RE & Jenkins DG. 2011. Biogeography and ecology: towards the integration of two disciplines. Philosophical Transactions of the Royal Society B 366: pp. 2438-2448.
Stork, N.E., McBroom, J., Gely, C. & Hamilton, A.J. 2015. New approaches narrow global species estimates for beetles, insects, and terrestrial arthropods. Proceedings of the National Academy of Sciences, 112(24), pp.7519-7523.
Tilman, D. 1982. Resource competition and community structure. Princeton: Princeton University Press.
Tilman, D., J. Knops, D. Wedin, P. Reich, M. Ritchie, & E. Siemann. 1997. The in?uence of functional diversity and composition on ecosystem processes. Science, 277: pp. 1300–1302.
Wake, D.B., Hadly, E.A. & Ackerly, D.D., 2009. Biogeography, changing climates, and niche evolution. Proceedings of the National Academy of Sciences, 106 (Supplement 2), pp. 19631-19636. Webb, C.O. et al. 2002. Phylogenies and community ecology. Annual Review of Ecology, Evolution and Systematics, 33:475-505. Wiens, J.J. 2004. Speciation and ecology revisited: phylogenetic niche conservatism and the origin of species. Evolution, 58: pp. 193-197.
Wiens, J.J., 2011. The niche, biogeography and species interactions. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 366(1576), pp. 2336-2350.
Wiens, J. & Donoghue, M. 2004. Historical biogeography, ecology and species richness. Trends in Ecology & Evolution, 9 (12): pp. 639 -644.
Wiens, J.A., Stralberg, D., Jongsomjit, D., Howell, C.A. & Snyder, M.A. 2009. Niches, models, and climate change: assessing the assumptions and uncertainties. Proceedings of the National Academy of Sciences, 106(Supplement 2), pp. 19729-19736.
Zhao, L., Zhang, Q.G. and Zhang, D.Y. 2016. Evolution alters ecological mechanisms of coexistence in experimental microcosms. Functional Ecology, 30(8), pp. 1440-1446.
O Conceito de Especiação e as Interações entre Plantas e Grandes Mamíferos
Lucas Ferreira do Nascimento
Especiação, dispersão, seleção e deriva ecológica podem ser consideradas as quatro classes de processos organizadores das comunidades (Vellend 2010). A diversidade de espécies de um determinado local depende fundamentalmente da composição e da diversidade regional de espécies (Cornell 1985; Ricklefs 1987) que, por sua vez, dependem dos processos de especiação (Vellend 2010). Tendo isso em vista, Vellend 2010 propõe que os processos de diversificação e dispersão da biota ao longo do tempo (responsáveis pelo surgimento de espécies num dado local) sejam tratados em ecologia de comunidades dentro da classe especiação. Desse modo, neste presente ensaio, o conceito de especiação engloba o contexto histórico e biogeográfico em que o pool regional de espécies originou-se. O meu objetivo aqui é discorrer sobre a importância do conceito de especiação na ecologia de comunidades e como esse conceito pode nos ajudar a fazer perguntas e previsões nos estudos de interações entre plantas e grandes mamíferos.
Em quase todo o século XX, as interpretações dos padrões das comunidades ignoraram os efeitos dos processos evolutivos e tiveram como premissa que a diversidade local é um resultado determinístico dos processos locais dentro de uma comunidade (Ricklefs 1987). Entre as décadas de 20 e 50, a competição foi vista como o principal processo organizador das comunidades, principalmente sob forte influência das formulações matemáticas de competição interespecífica de Lotka & Volterra, dos experimentos de exclusão competitiva de Gause e da teoria de nicho de Hutchinson. Na década de 60, a partir do desenvolvimento da Biogeografia de Ilhas, o contexto histórico e geográfico começou a ter uma maior presença na ecologia de comunidades. A teoria de Biogeografia de Ilhas incorporou explicitamente um contexto regional, pelo qual a imigração de espécies a partir de um continente fonte de colonizadores compensa processos locais responsáveis pela coexistência e extinção (MacArthur & Wilson 1967). Mais tarde, na década de 80, alguns trabalhos que investigaram a relação entre padrões locais e regionais ganharam mais destaque (Cornell 1985, Ricklefs 1987). Ricklefs 1987 não considerou explicitamente a especiação mas chamou atenção para a questão dos trabalhos em ecologia de comunidades não considerarem processos históricos em grande escala espacial e temporal que, por sua vez, estão relacionados aos processos de especiação. De um modo geral, ao longo do século XX, a especiação e os processos históricos que levaram ao surgimento de novas espécies num dado local não tiveram um papel central na ecologia de comunidades, sendo que o contexto histórico de como as espécies surgem num determinado local teve mais destaque no campo da Biogeografia e Macroevolução (Ricklefs 1987). Por fim, a especiação foi finalmente incorporada de forma explícita em ecologia de comunidades com os modelos de metacomunidades e a teoria neutra de Hubbell. De acordo com a teoria neutra de Hubbell, o número de espécies no equilíbrio dentro de uma metacomunidade depende de uma taxa constante de especiação e do número total de indivíduos, pelo qual pode variar com o tamanho da região (Hubbel 2001).
Especiação parece ser crítica para o entendimento de pelo menos dois padrões de diversidade de espécies em comunidades (Vellend 2010): (1) áreas de mesmo tamanho, sob condições ambientais similares e em regiões geográficas diferentes contém números de espécies diferentes (Ricklefs 2008); (2) a diversidade de espécies de um determinado local está relacionada aos gradientes ambientais desse local (Ricklefs 2004). Por exemplo, Brown et al. 2000 documentou uma maior riqueza de donzelinhas (Enallagma) em lagos com peixes predadores do que em lagos sem peixes predadores. Eles reconstruíram a preferência de habitat sob a filogenia de donzelinhas e sugeriram que a grande diversidade de espécies nos lagos com peixes refletem a mudança recente para os lagos sem peixes, embora as taxas de diversificação podem ter atuado como mecanismo adicional. Em outro estudo com abordagens filogenéticas, Wiens et al. 2007 investigaram um padrão recorrente, no qual há uma maior riqueza de espécies em elevações médias. Usando salamandras como modelo de estudo, eles encontraram que a taxa de diversificação das salamandras não foi diferente em diferentes elevações mas as elevações médias foram colonizadas primeiro, assim eles concluíram que houve mais tempo para um maior número de espécies acumularem nas áreas de elevações médias, mostrando a importância de processos históricos em ecologia de comunidades.
O conceito de especiação, sensu Vellend, também têm contribuído para um melhor entendimento de como as interações entre plantas e grandes mamíferos moldaram determinados caracteres das plantas. Numa floresta tropical da Costa Rica, a existência de plantas nativas com frutos grandes e carnosos que só poderiam ser dispersos efetivamente por megafauna (> 44 kg) parecia não fazer sentido, uma vez que quase não há megafauna nativa na Costa Rica (Janzen & Martin 1982). Desta forma, Janzen & Martin 1982, ao considerar o contexto histórico dessas comunidades propuseram que estes frutos poderiam ser resultado de seleção exercida pela megafauna extinta no final do pleistoceno. Esses autores propuseram o termo “anacronismo” para designar caracteres que foram moldados por interações extintas. Muitos caracteres anacrônicos têm sido identificados em plantas (Barlow 2002, Galetti et al. 2017, Guimarães et al. 2008, Janzen & Martin 1982, Janzen 1986). Por exemplo, espinhos de espécies de cactos do gênero Opuntia do deserto de Nopaleras, no México, podem ser resultado de seleção natural exercida pela herbivoria da megafauna extinta (Janzen 1986). Em Madagascar e na Nova Zelândia também não há grandes herbívoros atualmente, contudo algumas espécies de plantas dessas regiões possuem uma arquitetura que parece ser anacrônica e provavelmente moldada pela pressão de herbivoria exercida por grandes aves extintas (família Ratite) (Bond & Silander 2007). Tanto os espinhos dos cactos de Nopaleras quanto a arquitetura das plantas de Madagascar e Nova Zelândia eram tidas como adaptações ao clima árido destas regiões. Isso exemplifica a importância de considerar o contexto histórico e o conceito de especiação para a investigação da evolução dos caracteres de plantas.
No meu projeto de mestrado, estamos tentando entender como as interações entre plantas e megafauna moldaram determinados caracteres de plantas, usando como modelo de estudo as espécies de palmeiras (Arecaceae) neotropicais. Desse modo, a especiação é um conceito central no meu projeto que, por sua vez, tem duas perguntas principais: 1) Quais espécies de palmeiras neotropicais possuem frutos com características selecionadas pela megafauna extinta no final do pleistoceno? 2) Uma vez que muitas espécies da megafauna extinta também poderiam consumir ou machucar outras partes das plantas (Göldel et al. 2016, Owen-Smith 1992), há uma relação positiva entre frutos anacrônicos e defesas anacrônicas em palmeiras neotropicais? Para responder essas perguntas, estamos investigando a história evolutiva dos caracteres dos frutos e defesas (principalmente espinhos) e como a evolução desses caracteres foram correlacionados ao longo da filogenia das palmeiras. Outra questão importante é como o surgimento desses caracteres podem ter influenciado as taxas de especiação das palmeiras. Tendo isso em vista, Onstein et al. 2017 encontraram que as palmeiras com frutos pequenos tiveram uma maior taxa de especiação do que as palmeiras com frutos grandes e carnosos (provavelmente dispersas pela megafauna).
Em adição ao contexto histórico, o efeito da especiação no contexto biogeográfico e no pool regional das espécies podem nos ajudar a entender melhor a distribuição geográfica das espécies de palmeiras. Por exemplo, Galetti et al. 2013 investigaram como o os frutos do palmito Juçara (Euterpe edulis) variaram de tamanho em áreas diferentes com dispersores de sementes de tamanhos diferentes. Eles concluíram que nas áreas onde há maiores dispersores de sementes o tamanho dos frutos do palmito Juçara são maiores do que nas áreas com menores dispersores de sementes. Nesse sentido, sabendo que a megafauna dos neotrópicos era mais abundante em áreas abertas como o cerrado (Owen-Smith 1992), será que demograficamente há mais indivíduos de palmeiras anacrônicas no cerrado? Adicionalmente, podemos nos perguntar qual foi o efeito da extinção da megafauna na distribuição geográfica das palmeiras. Podemos esperar que houve maiores mudanças geográficas nas palmeiras com frutos anacrônicas do que em outras espécies de mesmo habitat mas não dispersas por megafauna. Por fim, através do conceito de especiação podemos investigar se a ocorrência de palmeiras com frutos grandes e carnosos nos neotrópicos é devido a especiação dessas palmeiras nos neotrópicos ou é simplesmente devido ao contexto histórico de dispersão de outra região (África por exemplo). Desse modo, investigaríamos se os caracteres anacrônicos de espécies de palmeiras neotropicais são necessariamente um resultado da seleção exercida pela megafauna neotropical.
Além de nos ajudar a fazer novas perguntas, o conceito de especiação proposto por Vellend 2010 nos ajuda a entender melhor como o estudo da seleção de caracteres de plantas por grandes mamíferos está inserido na ecologia de comunidades. Investigar as interações entre plantas e grandes mamíferos pode nos ajudar a entender melhor a distribuição geográfica, evolução de caracteres e as taxas de diversificação das plantas. Consequentemente, o estudo das interações entre plantas e grandes mamíferos pode nos ajudar a compreender os processos responsáveis pelos padrões de diversidade das comunidades, pelo qual é o principal objetivo da ecologia de comunidades.
Referências bibliográficas
Barlow, C. (2002). The ghosts of evolution: nonsensical fruit, missing partners, and other ecological anachronisms. Basic Books.
Bond, W. J., & Silander, J. A. (2007). Springs and wire plants: anachronistic defences against Madagascar’s extinct elephant birds. Proceedings of the Royal Society B: Biological Sciences, 274(May), 1985–1992. https://doi.org/10.1098/rspb.2007.0414
Brown, J. M., McPeek, M. A., & May, M. L. (2000). A phylogenetic perspective on habitat shifts and diversity in the north American Enallagma damselflies. Systematic Biology, 49(4), 697–712. https://doi.org/10.1080/106351500750049789
Cornell, H. V. (1985). Local and Regional Richness of Cynipine Gall Wasps on California Oaks. Ecology, 66(4), 1247–1260.
Galetti, M., Guevara, R., Côrtes, M. C., Fadini, R., Matter, S. Von, Leite, A. B., … Jordano, P. (2013). Functional Extinction of Birds Drives Rapid Evolutionary Changes in Seed Size. Science, 340(May).
Galetti, M., Mole, M., Jordano, P., Pires, M. M., Paulo, R., Pape, T., … Marquis, R. J. (2017). Ecological and evolutionary legacy of megafauna extinctions. https://doi.org/10.1111/brv.12374
Göldel, B., C. Araujo, A., Kissling, W. D., & Svenning, J.-C. (2016). Impacts of large herbivores on spinescence and abundance of palms in the Pantanal, Brazil. Botanical Journal of the Linnean Society, 182, 465–479.
Guimarães, P. R., Galetti, M., & Jordano, P. (2008). Seed dispersal anachronisms: Rethinking the fruits extinct megafauna ate. PLoS ONE, 3(3). https://doi.org/10.1371/journal.pone.0001745
Hubbell, S. P. (2001). The unified neutral theory of biodiversity and biogeography. Monographs in Population Biology 32. Princeton University Press, Princeton, NJ.
Janzen, D. H., & Martin, P. S. (1982). Neotropical Anachronisms: The Fruits the Gomphotheres Ate. Science. https://doi.org/10.1126/science.215.4528.19
Janzen, D. H. (1986). Chihuanhuan desert nopaleras: defaunated big mammal vegetation.Ann.Rev.Ecol.Syst.,17,595–636. https://doi.org/0066-4162/86/1120-0595$02.00
MacArthur R. H., Wilson E. O. (1967). The theory of island biogeography. Princeton (NJ): Princeton University Press
Onstein, R. E., Baker, W. J., Couvreur, T. L. P., Faurby, S., Svenning, J.-C., & Kissling, W. D. (2017). Frugivory-related traits promote speciation of tropical palms. Nature Ecology & Evolution. https://doi.org/10.1038/s41559-017-0348-7
Owen-Smith, R. N. (1992). Megaherbivores: the influence of very large body size on ecology. Cambridge university press.
Ricklefs, R. E. (1987). Community Diversity: Relative Roles of Local and Regional Processes. Science, 235, 167–171.
Ricklefs, R. E. (2004). A comprehensive framework for global patterns in biodiversity. Ecology Letters, 7(1), 1–15. https://doi.org/10.1046/j.1461-0248.2003.00554.x
Ricklefs, R. E. (2008). Disintegration of the Ecological Community. The American Naturalist, 172(6), 741–750. https://doi.org/10.1086/593002
Vellend, M. (2010). Conceptual Synthesis in Community Ecology. The Quarterly Review of Biology, 85(2), 183–206. https://doi.org/10.1086/652373
Wiens, J. J., Parra-Olea, G., Garcia-Paris, M., & Wake, D. B. (2007). Phylogenetic history underlies elevational biodiversity patterns in tropical salamanders. Proceedings of the Royal Society B: Biological Sciences, 274(1612), 919–928. https://doi.org/10.1098/rspb.2006.0301
Vellend como ferramenta conceitual para a comparação entre dois ambientes contrastantes
Marcelo Petratti Pansonato
A ecologia de comunidades é um campo da ciência que busca compreender como e por quais razões a riqueza, a composição e a abundância das espécies variam entre diferentes locais. Ao longo do tempo, grandes esforços foram empregados a fim de responder questões relacionadas a estes temas. O resultado, porém, é que a ecologia de comunidades se tornou uma bagunça (Lawton 1999; Roughgarden 2009). Baseada majoritariamente em estudos empíricos, padrões gerais que sejam aplicáveis à todos os tipos de organismos e ambientes raramente foram e são identificados. Na verdade, a imensa variedade de combinações possíveis de interações entre os organismos e seu meio fez com que os cientistas que trabalham com ecologia de comunidades buscassem explicações adequadas a cada caso. Com isso, se formou uma verdadeira “torre de babel” de processos e padrões não generalizáveis além do escopo de cada sub área da ecologia de comunidades. Com o objetivo de ordenar e simplificar a teoria de ecologia de comunidades, Vellend (2010) propõe o agrupamento de todos os processos relacionados a formação de comunidades ecológicas dentro de quatro processos principais: Especiação, Dispersão, Deriva e Seleção. O autor chama essa síntese de teoria das comunidades ecológicas.
De acordo com a teoria proposta por Vellend (2010) os processos de especiação e dispersão são responsáveis pelo acréscimo de novas espécies às comunidades (Figura 1). A especiação – criação de novas espécies – historicamente foi tratada em estudos biogeográficos e macroevolutivos (Brown 1995). A especiação é um componente determinante para a compreensão de padrões que refletem a ação de processos históricos e geográficos sobre a dinâmica das comunidades (Vellend 2016; Ricklefs & Schluter 1993). Em estudos de comunidades fechadas, em escalas locais e ambientes homogêneos parece razoável deixar as questões relacionadas à especiação de lado, uma vez que o que interessa é a constituição atual da comunidade e seus atributos (Vellend 2010). Por outro lado, em estudos realizados em escalas mais amplas, que avaliam diferentes regiões geográficas e que abrangem certos níveis de heterogeneidade ambiental é importante considerar o contexto biogeográfico e evolutivo que deu origem ao pool regional de espécies (Ricklefs 1987). A dispersão – o movimento de organismos através do espaço – é um processo essencial para diversas teorias de ecologia de comunidades como a Biogeografia de Ilhas (MacArthur & Wilson 1967) e Metacomunidades (Leibold et al. 2004). É determinante para a manutenção da diversidade e a distribuição espacial das espécies em escalas locais e regionais (Hubbell 1979; Clark et al. 1999). A dispersão, por também influenciar variações nas abundâncias relativas das espécies, tem efeitos significativos sobre a dinâmica de comunidades ecológicas.
Os processos responsáveis pela perda de espécies em uma comunidade são a deriva e a seleção (Figura 1) (Vellend 2010). A deriva ecológica, – mudanças aleatórias nas abundâncias relativas das espécies – é um processo que se baseia na premissa de que as taxas de nascimento, morte e reprodução dos indivíduos são aleatórias em uma comunidade fechada, o que caracteriza a estocasticidade demográfica (Vellend 2016). Variações na probabilidade de ocorrência de cada taxa vital acarretam em mudanças nas abundâncias das espécies. Modelos mais realistas incluem também a probabilidade de imigração e extinção (Hubbell 2001). A seleção – diferença determinística de fitness entre indivíduos de diferentes espécies – pode ser entendida como o balanço das interações intra e interespecíficas e da relação das espécies com o ambiente. A seleção pode atuar de diferentes maneiras, variando sua direção e intensidade ao longo do tempo e do espaço (Nowak 2006). É importante mencionar que os quatro processos elementares propostos por Vellend (2010) interagem entre si. Por exemplo, diferenças de fitness entre espécies determinam variações em suas taxas vitais que, por sua vez, podem afetar o resultado do elemento estocástico do processo de deriva. Como outro exemplo, a teoria neutra consiste de uma interação entre os processos de especiação, dispersão e deriva (Hubbell 2001).
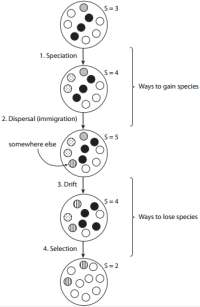 Figura1: Os quatro processos que fazem o número de espécies em uma comunidade mudar. Cada círculo pequeno é um indivíduo e seu preenchimento indica sua espécie.
Figura1: Os quatro processos que fazem o número de espécies em uma comunidade mudar. Cada círculo pequeno é um indivíduo e seu preenchimento indica sua espécie.
A teoria de comunidades ecológicas proposta por Vellend (2010) possui a vantagem de organizar de maneira lógica e simplificada o material produzido por ecólogos de comunidades ao longo do tempo, o que facilita o entendimento e a didática da matéria. Também, esclarece as semelhanças e diferenças entre as inúmeras abordagens conceituais e teóricas da ecologia de comunidades. Além disso, articula uma teoria geral sobre ecologia de comunidades: “espécies são adicionadas às comunidades através dos processos de especiação e dispersão, e a abundância relativa dessas espécies é controlada por deriva e seleção, sob a influência da dispersão, os quais governam a dinâmica de comunidade” (Vellend 2010). Embora a teoria proposta por Vellend (2010) se aplique aos mais diversos tipos de comunidades e organismos, o autor reconhece que a importância relativa de cada um dos quatro principais processos deve variar (Vellend 2016). Como exemplo, Vellend afirma que: “A importância da seleção versus da deriva, em definir a trajetória e o resultado da dinâmica da comunidade local depende se os objetos de estudo são plantas em uma pastagem, libélulas em um lago, besouros em um recipiente de laboratório ou aves em uma floresta”. Desta forma é razoável supor que, mesmo dentro de uma única guilda, a importância relativa de cada processo também varie entre ambientes ecologicamente e historicamente contrastantes.
Para melhor ilustrar a importância da teoria de comunidades de Vellend para uma readequação da minha tese, me permito neste momento fazer um breve retrospecto das ideias inicialmente trabalhadas. A princípio eu buscava compreender a importância relativa de processos determinísticos e neutros sobre a estruturação de comunidades de espécies arbóreas em florestas de restingas e florestas de encosta. Boa parte dessa linha de raciocínio teve origem nas referências bibliográficas que utilizei durante meu mestrado, de 2009 à 2011. Algum tempo, estudos e disciplinas depois do meu ingresso no doutorado ficou claro que a dicotomia entre processos determinísticos e neutros já não é mais uma abordagem que contribui para o avanço da ecologia de comunidades. Como a escala espacial do meu atual estudo é muito maior do que a que utilizei anteriormente, apenas os processos relacionados à seleção (determinísticos) e à deriva (neutros) parecem não ser suficientes para compreender os padrões encontrados ao longo de quase todo o litoral brasileiro. De fato, minha área de estudo compreende diversos setores biogeográficos (Fiaschi & Pirani 2009) e compara ambientes que se originaram em períodos geológicos bastante distintos (Suguio & Tessler 1984). Certamente, além da seleção e deriva, os processos de especiação (dentro e entre as regiões biogeográficas) e de dispersão (de um ambiente mais antigo para um mais recente) também atuam de maneira determinante em moldar as comunidades de árvores que estudo.
Agora, pretendo inserir um contexto teórico mais abrangente ao meu estudo, como o proposto pelo Vellend (2010), que aparentemente é capaz de contemplar todos os processos essenciais à estruturação das comunidades com que trabalho. Mais especificamente, pretendo discorrer sobre possíveis variações na importância relativa dos quatro processos essenciais descritos por Vellend (2010) quando são comparados dois ambientes contrastantes em termos bióticos e abióticos. Minha ideia é focar nos processos atuando independentemente, suas possíveis interações estão fora do escopo deste ensaio. Para tal, imagine dois ambientes limítrofes. Um deles é geologicamente recente, possui solos pobres em nutrientes e outros fatores considerados limitantes ao desenvolvimento vegetal. Também, neste ambiente restritivo, a riqueza de espécies arbóreas é relativamente baixa e as comunidades tendem a apresentar alta dominância por poucas espécies, o que conduz a uma baixa diversidade. Este ambiente pode ser representado pelas florestas de restingas, que ocorrem nas planícies litorâneas sobre solos arenosos. O segundo ambiente é geologicamente antigo, possui solos mais férteis e outros atributos que o tornam menos restritivo ao desenvolvimento vegetal. Neste ambiente a riqueza de espécies é mais alta e suas distribuições de abundância, em geral, são mais equitativas, o que conduz a níveis mais altos de diversidade. Este ambiente pode ser representado pelas florestas de encostas, que em geral possuem solos mais argilosos. Por fim, vale mencionar que a área coberta pelas florestas de encosta é muito maior do que a coberta pelas florestas de restinga.
Qual o papel da especiação neste contexto? Para as florestas de restinga, que são geologicamente mais recentes, com cerca de 5.000 – 15.000 anos de idade, a especiação parece não ter desempenhado um papel relevante na adição de espécies às comunidades. As espécies presentes nas restingas são em sua grande maioria um subconjunto das espécies presentes em outras formações da Mata Atlântica e outros biomas. É possível que o pouco tempo decorrido da origem destes ambientes não tenha sido suficiente para que eventuais isolamentos reprodutivos resultassem em espécies novas. Talvez seja por isso que poucos endemismos sejam conhecidos para as restingas, em relação a outros hábitats mais antigos da Mata Atlântica (Scarano 2002). Por outro lado, as florestas de encostas encontram-se sobre locais que se formaram à cerca de 130 milhões de anos atrás. Consequentemente, a especiação deve ter um papel mais importante no acréscimo de espécies em ambientes mais antigos, uma vez que a especiação é um processo relativamente lento, ao menos para as plantas de ciclo de vida longo. Uma evidência indireta são as altas taxas de endemismo que ocorrem nesta formação florestal.
A dispersão provavelmente é um processo determinante para as relações florísticas entre os dois ambientes. No entanto, uma vez que as florestas de encosta detêm quase todo o pool regional de espécies, o efeito de adição de novas espécies pelo processo de dispersão de ser mais relevante para as restingas. Caso isso seja realidade, o modelo que melhor descreve a dinâmica da dispersão entre os dois ambientes possivelmente é o da teoria de biogeografia de ilhas, em que as florestas de encostas atuariam como uma fonte constante de propágulos em direção às restingas. Por outro lado, efeito da dispersão das restingas para as florestas de encostas pode estar mais relacionado com variações na abundância das espécies presentes nas encostas, o que é mais congruente com a teoria de metacomunidades.
Uma moeda jogada na restinga deve ter a mesma probabilidade de dar cara ou coroa do que uma moeda jogada na encosta (excluindo-se o efeito do relevo, claro)? Possivelmente sim, mas nas restingas o risco da aposta parece ser mais alto. Como a deriva ecológica é uma consequência da estocasticidade demográfica, o efeito deste processo sobre a perda de espécies depende de alguns atributos das comunidades. Assim, vamos considerar cada ambiente – restingas e encostas - como uma comunidade fechada, onde a abundância relativa das espécies varia em uma dinâmica Browniana. Comunidades com muitos indivíduos e muitas espécies tendem a demorar mais tempo para atingir a monodominância, mantendo-se tudo o mais constante. Assim, podemos inferir que a as florestas de encosta sofrem um efeito relativamente menor da deriva quando comparadas com as florestas de restinga. Isso por que as comunidades nas restingas tendem a ser menores e com maior dominância, o que pode acentuar a perda de espécies por processos puramente estocásticos.
A seleção parece desempenhar um papel fundamental em meu sistema de estudo. As florestas de encostas são praticamente limítrofes com as florestas de restinga. Portanto, se o único processo determinando a estrutura destes dois ambientes fosse a dispersão seria esperada uma baixa diversidade beta entre os dois ambientes. No entanto, parece que boa parte das espécies que, em teoria, seriam capazes de dispersar seus propágulos das encostas para as restingas não as colonizam efetivamente. Desta forma, é razoável supor que as condições mais limitantes das restingas atuem como um filtro ambiental que seleciona apenas espécies que sejam tolerantes às suas condições locais. Possivelmente, a amplitude de variação dos atributos funcionais presentes nas espécies que coexistem nas restingas é menor do que a existente nas florestas de encostas. Por essas razões, a seleção deve ter uma importância relativa maior na estruturação das comunidades de restinga do que de encostas.
Posso concluir que, ao menos teoricamente, os quatro processos propostos por Vellend (2010) em sua teoria de ecologia de comunidades são relevantes para os dois ambientes que estudo. No entanto, uma análise comparativa entre cada tipo de ambiente e de suas conexões sugere que cada processo possui uma importância relativa distinta.
Referências Bibliográficas
Brown, J. H. 1995. Macroecology. University of Chicago Press, Chicago.
Clark, J. S., Silman, M., Kern, R., Macklin, E., & HilleRisLambers, J. 1999. Seed dispersal near and far: patterns across temperate and tropical forests. Ecology, 80(5), 1475-1494.
Fiaschi, P., & Pirani, J. R. (2009). Review of plant biogeographic studies in Brazil. Journal of systematics and evolution, 47(5), 477-496.
Hubbell, S. P. 1979. Tree dispersion, abundance, and diversity in a tropical dry forest. Science, 203(4387), 1299-1309.
Hubbell S. P. 2001. The Unified Neutral Theory of Biogeography and Biodiversity. Princeton (NJ): Princeton University Press.
Lawton J. H. 1999. Are there general laws in ecology? Oikos 84(2):177–192.
Leibold, M. A., Holyoak, M., Mouquet, N., Amarasekare, P., Chase, J. M., Hoopes, M. F., … & Loreau, M. 2004. The metacommunity concept: a framework for multi?scale community ecology. Ecology letters, 7(7), 601-613.MacArthur, R.M. & Wilson, E.O. 1967. The theory of island biogeography. Princeton University Press.
Nowak M. A. 2006. Evolutionary Dynamics: Exploring the Equations of Life. Cambridge (MA): Belknap Press of Harvard University Press.
Ricklefs R. E. 1987. Community diversity: relative roles of local and regional processes. Science 235(4785):167–171.
Ricklefs R. E., Schluter D. 1993. Species Diversity in Ecological Communities: Historical and Geographical Perspectives. Chicago (IL): University of Chicago Press.
Roughgarden J. 2009. Is there a general theory of community ecology? Biology and Philosophy 24(4): 521–529.
Scarano, F. R. 2002. Structure, function and floristic relationships of plant communities in stressful habitats marginal to the Brazilian Atlantic rainforest. Annals of Botany, 90(4), 517-524.
Suguio, K., & Tessler, M. G. 1984. Planícies de cordões litorâneos quaternários do Brasil: origem e nomenclatura. LACERDA, LD; ARAÚJO, DSD; CERQUEIRA, R. & TURQ, B. Restingas: Origem, estrutura e processos. Niterói, CEUFF, 15-26.
Vellend, M. 2010. Conceptual synthesis in community ecology. Quarterly Review of Biology 85:183–206.
Vellend, M. 2016. The theory of ecological communities (MPB-57). Princeton University Press.


